1、选择题 按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
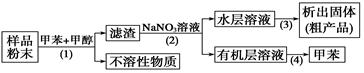
下列说法错误的是? ( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
参考答案:C
本题解析:A项,步骤(1),由于得到不溶性物质,所以应采取过滤的方法,正确。B项,步骤(2),由于得到有机层和水层,所以应用分液漏斗分离,正确。C项,从水溶液中获得固体,应采取蒸发结晶或浓缩冷却结晶的方法,应用蒸发皿,错误。D项,从有机层中获得甲苯,应根据沸点不同,采用蒸馏装置,正确。
本题难度:一般
2、选择题 用pH试纸测定某无色溶液的pH,正确的操作是( )
A.将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照
B.将溶液倒在pH试纸上,观察其颜色变化并与标准比色卡对照
C.用干燥、洁净玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照
D.在试管内放入少量溶液并煮沸,把pH试纸放在管口观察其颜色并与标准比色卡对照
参考答案:C
本题解析:用pH试纸测定某无色溶液的pH,正确的操作是用干燥、洁净玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照,答案选C。
点评:该题是基础性试题的考查,属于常规性实验操作,难度不大,记住操作要点即可,有利于培养学生的规范实验设计能力和动手操作能力,提高学生的学习积极性。
本题难度:简单
3、选择题 下列实验能达到预期目的的是( )
编号
| 实验内容
| 实验目的
|
A.
将SO2通入溴水,溴水褪色后加热观察能否恢复原色
验证SO2漂白的可逆性
B.
将氯水加入淀粉KI溶液中
验证Cl的非金属性比I强
C.
把铁块和铜块用导线连接插入浓硝酸中
组成原电池验证Fe比Cu活泼
D.
加热氯化铵和碘单质的固体混合物
分离除去碘单质
|
题型:单选题难度:中档来源:不详 答案
A项,将SO2通入溴水,溴水褪色是发生了化学反应:Br2+2H2O+SO2==2HBr+H2SO4,此反应不可逆,加热恢溴水不可恢复原色,不能用来验证SO2漂白的可逆性,A项不正确。将氯水加入淀粉KI溶液中,发生氧化还原反应:Cl2+2KI=2KCl+I2,其中氧化剂是Cl2,氧化产物是I2,得Cl2的氧化性比I2强,所以Cl的非金属性比I强,B正确。C项中的铁块插入浓硝酸中,发生钝化,做正极,Cu做负极,该原电池不能验证Fe比Cu活泼,C不正确。
碘单质易升华,加热不能分离除去,D不正确。
马上分享给同学