|
高中化学知识点讲解《反应速率与平衡的有关计算》高频考点预测(2017年最新版)(二)
2018-03-17 05:45:24
来源:91考试网
作者:www.91exam.org 【 大 中 小】
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。则此温度下平衡常数K=____________
参考答案:(1)BC(2)-1224.96 kJ·mol-1(3)K=13.3
本题解析:
(1)该反应放热,降低温度,反应向正向进行(tip: 的箭头方向指向加热时反应移动方向),选B。增加反应物浓度,反应向正向进行,选C 的箭头方向指向加热时反应移动方向),选B。增加反应物浓度,反应向正向进行,选C
(2)由化学方程式列等式 解出 解出 = =
(3)根据化学平衡常数
本题难度:一般
3、填空题 I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2? ?N2O4 ΔH=-57 kJ/mol, ?N2O4 ΔH=-57 kJ/mol,

当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
(1)C中的气体颜色__________; (填“变浅”或“变深”)。
(2)若25℃时,起始时仅有NO2气体,达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=
0.0321mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
Ⅱ. 在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
① 推进针筒后颜色变深的原因是?;
②一段时间后气体颜色又变浅的原因是?
③?在此过程中,该反应的化学平衡常数将??(填“增大”、“减小”或“不变”,下同)NO2的转化率将?。
参考答案:I.(1)变浅?(2)0.0767 mol/L? 83.7%
Ⅱ.(1)①气体的体积减小,NO2浓度增大,气体的颜色加深
②增大压强,减小气体的体积,平衡向正反应方向移动?③不变?增大
本题解析:I.(1)硝酸铵溶于水吸热,且该反应的正反应是放热反应,所以C中平衡向正反应方向移动,颜色变浅。
(2)达到平衡时,c(NO2)=0.012 5 mol/L,c(N2O4)=0.032 1 mol/L,则消耗NO2的浓度是0.032 1 mol/L×2=0.0642 mol/L,所以NO2的起始浓度是0.012 5 mol/L+0.0642 mol/L=0.0767 mol/L。则NO2的转化率为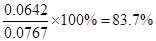 。 。
Ⅱ.(1)①气体的体积减小,因此NO2浓度增大,所以气体的颜色加深。
②增大压强,减小气体的体积,平衡向正反应方向移动,因此一段时间后气体颜色又变浅。
③平衡常数只与温度有关系,所以改变压强,平衡常数不变;平衡向正反应方向移动,所以反应物的转化率增大。
点评:该题是中等难度的试题,试题注重基础,侧重能力的考查和训练。该题有利于培养学生的逻辑思维能力和发散思维能力,有助于培养学生分析问题、解决问题的能力。
本题难度:一般
4、填空题 溴及其化合物广泛应用于医药、农药、纤维、塑料组燃剂等,回答下列问题:
(1)海水提溴过程中,向浓缩的海水中通入??,将其中的Br - 氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为?。
(2)溴与氯能以共价键结合形成BrCl。BrCl分子中,?显正电性。BrCl与水发生反应的化学方程式为?。
(3)CuBr2分解的热化学方程式为:
2CuBr2(s)="2CuBr(s)+" Br2(g)?△H=+105.4kJ/mol-1
在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会?(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为?。
参考答案:
(1)Cl2?3Br2+6CO32-+3H2O=5Br-+ BrO3-+6HCO3-
(2)Br?BrCl+H2O="HCl+HBrO"
(3)①增大?②2.33×103Pa<p(Br2)≤4.66×103Pa
本题解析:
(1)通入氯气,把溴离子氧化为溴单质;溴在碳酸钠溶液的歧化可把反应理解为,溴与水发生歧化,产生H+的被碳酸钠吸收。
(2)溴的非金属性弱于氯的,故溴显正电性;与Cl2与H2O类似,BrCl与水发生反应的化学方程式为:BrCl+H2O=HCl+HBrO。
(3)①升高温度,平衡向吸热反应方向移动,因而可提高p(Br2);②体积增大一倍时,p(Br2)降为原来的一半,即2.33×103Pa,减压使平衡向气体体积数增大的方向移动,因而会大于2.33×103Pa;若反应物足量,可平衡恢复到原有的p(Br2)。
本题难度:一般
5、选择题 一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
?
| 甲
| 乙
| 丙
| 丁
| 密闭容器体积/L
| 2
| 2
| 2
| 1
| 起始物质的量
| n(SO2)/mol
| 0.4
| 0.8
| 0.8
| 0.4
| n(O2)/mol
| 0.24
| 0.24
| 0.48
| 0.24
| SO2的平衡转化率/%
| 80
| α1
| α2
| α3
|
?
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
参考答案:B
本题解析:A、温度一定,平衡常数不变,错误;B、甲中平衡常数K=  = =  =400,正确;C、乙和丙中二氧化硫起始量相同,但丙中氧气物质的量大于乙中氧气物质的量,所以α1<α2,丙和丁中二氧化硫和氧气起始浓度相同,平衡等效,二氧化硫转化率相等,错误;D、丙和丁平衡等效,三氧化硫浓度相同;丙中二氧化硫和氧气起始浓度是甲中二氧化硫和氧气起始浓度的2倍,浓度加倍等效于增大压强,所以丙中三氧化硫浓度大于甲中三氧化硫浓度,错误。 =400,正确;C、乙和丙中二氧化硫起始量相同,但丙中氧气物质的量大于乙中氧气物质的量,所以α1<α2,丙和丁中二氧化硫和氧气起始浓度相同,平衡等效,二氧化硫转化率相等,错误;D、丙和丁平衡等效,三氧化硫浓度相同;丙中二氧化硫和氧气起始浓度是甲中二氧化硫和氧气起始浓度的2倍,浓度加倍等效于增大压强,所以丙中三氧化硫浓度大于甲中三氧化硫浓度,错误。
本题难度:一般
|