1、计算题 在某温度下,将H2(g)和I2(g)各0.1mol的气体混合物充入10L的密闭容器中,充分反应,达到平衡时,测得c(H2)=0.0080mol/L,
求:
(1)求该反应的平衡常数。(4分)
(2)在上述温度下,该容器中若充入的H2(g)和I2(g)各0.2mol,求达到化学平衡时HI(g)的平衡浓度。(4分)
参考答案:(1)依题意可知,平衡时[H2]=[I2]=0.0080mol/L,
H2(g) + I2(g) 2HI(g)
2HI(g)
起始时各物质的浓度(mol·L-1) 0.010 0.010 0
各物质的浓度变化量(mol·L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol·L-1) 0.0080 0.0080 0.0040
根据平衡常数的概念可得
K= C(HI)2/C(H2)C(I2)="(0.0040" mol·L-1)2/(0.0080 mol·L-1)2="0.25?" ( 4分)
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L
H2(g) + I2(g)  2HI(g)
2HI(g)
起始时各物质的浓度(mol·L-1) 0.02 0.02 0
各物质的浓度变化量(mol·L-1) x x 2x
平衡时各物质的浓度(mol·L-1) 0.02-x 0.02-x ? 2x
K=C(HI)2/C(H2)C(I2)=(2x)2/[(0.02-x)×(0.02-x)]="0.25"
解得:x="0.004" mol/L ;
故平衡时? C(HI)=0.008mol·L-1。?(4分)
本题解析:略
本题难度:简单
2、选择题 在2L恒容密闭容器中发生反应:2A(g)+B(g)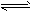 2C(g),若最初加入的A和B都是4mol,10 s后反应达到平衡,此时间段A的平均反应速率是0.12mol·L-1·s-1,则平衡后,容器中B的物质的量浓度为
2C(g),若最初加入的A和B都是4mol,10 s后反应达到平衡,此时间段A的平均反应速率是0.12mol·L-1·s-1,则平衡后,容器中B的物质的量浓度为
[? ]
A.2.8 mol·L-1
B.1.4 mol·L-1
C.3.2 mol·L-1
D.3.6 mol·L-1
参考答案:B
本题解析:
本题难度:简单
3、选择题 1 mol A气体与n mol B气体按下式反应生成气体C:A(g)+nB(g) mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是(? )
mC(g),反应一段时间后,测得A的转化率是50%,此时气体的密度是反应前(同温同压)的4/3,则n和m的数值可能是(? )
A.n="1,m=1"
B.n="3,m=3"
C.n="2,m=3"
D.n=3,m=2.
参考答案:A
本题解析:根据反应方程式和题意列方程式讨论
A(g)+nB(g) ====mC(g)
起始:? 1? n
反应:? 0.5? 0.5n? 0.5m
平衡:? 0.5 ?0.5n? 0.5m
则( 0.5+0.5n+0.5m)/(1+n)=3/4
即1+n=2m
讨论可知 n=1,m=1。
本题难度:简单
4、填空题 在铝与稀硫酸的反应中,已知10s末,硫酸的浓度减少了0.6mol·L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是________________________。
参考答案:0.02mol·(L·s)-1
本题解析:
本题难度:一般
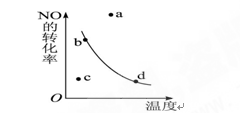
5、选择题 如右图中的曲线是表示其他条件一定时,2NO+O2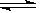 2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是? (? )
2NO2(正反应是放热反应)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是? (? )
A.a
B.b
C.c
D.d
参考答案:C
本题解析:曲线表示平衡曲线,即曲线上的任意一点都表示平衡点。a和c是非平衡点,其中a点要达到平衡状态,则NO的转化率将降低,这说明反应是向逆反应方向移动的,所以v(正)<v(逆),故正确的答案选C。
点评:该题是中等难度的试题,试题设计新颖,基础性强,在注重对学生基础知识巩固和训练的图书,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是明确图像中曲线表示的含义,然后灵活运用即可。
本题难度:简单