1、选择题 钨是我国的丰产元素之一。已知钨有多种天然稳定同位素,其相对原子质量为:183.84,有关叙述中正确的是(?)
A.183.84是1个钨原子质量与12C原子质量的1/12的比值
B.183.84是各种钨同位素的质量数和它们所占百分数得出的平均值
C.钨的同位素原子中的质子数和中子数约略相等
D.钨同位素原子的中子数远比其中的质子数要多
参考答案:D
本题解析:
【错解分析】短周期元素的原子核内原子数与中子数相等或约略相等,但H无中子。长周期元素的原子核里中子数均比质子数大得多,钨为长周期元素所以中子数比质子数明显的多。
【正解】相对原子质量对于有多种天然稳定的同位素的元素而言,不是“1个原子”与12C原子1/12的质量比值,因为只与一 种同位素的质量相比,仅是“该同位素的相对原子质量”。错解的产生是因对相对原子质量的理解不透。B选项也不正确,一为“质量数”,一为“百分数”,后者未指明是原子百分数还是质量百分数。若为原子百分数。其求得的值只是“近似相对原子质量”。C,D选项的判断要归纳和观察原子序数的大小不同时,原子核内质子数与中子数的比例关系。
本题难度:简单
2、选择题 下列说法正确的是
A.L层上的电子数为奇数的原子一定是主族元素的原子
B.元素周期表共有18列,第8列属于第ⅧB族、第17列属于第VIIA族
C.化学键的形成一定伴随着电子的转移和能量变化
D.元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
参考答案:A
本题解析:A、L层上的电子数为奇数的原子位于第二周期,一定是主族元素的原子,正确;B、元素周期表共有18列,第8列属于第Ⅷ族、第17列属于第VIIA族,错误;C、化学键的形成不一定伴随着电子的转移,如蒸发氯化钠溶液的氯化钠晶体,形成了离子键但没有电子转移,错误;D、元素周期表中,位于第ⅢB族到ⅡB族的10个纵行的元素属于过渡元素,错误。
本题难度:一般
3、选择题 下列关于ⅦA族元素的叙述正确的是(?)
A.ⅦA族元素是同周期中原子半径最大的元素
B.ⅦA族元素是同周期中非金属性最弱的元素
C.ⅦA族元素的最高正价都是+7价
D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数
参考答案:D
本题解析:同周期自左向右原子半径逐渐减小,非金属性逐渐增强,所以ⅦA族元素是同周期中原子半径最小的元素,ⅦA族元素是同周期中非金属性最强的元素,A、B不正确。C不正确,F没有正价,所以正确的答案选D。
本题难度:简单
4、填空题 (13分)、短周期元素X、Y、Z、W、Q的原子序数依次增大,Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料。请回答:
(1)Y在元素周期表中的位置是 。
(2)X2Z的电子式是 。
(3)W2Z2与X2Z反应的化学方程式是 。
(4)上述元素中有两种非金属元素位于同一主族。能证明它们非金属性强弱的一个反应的化学方程式是 。
(5)在 25℃、101 kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0 kJ。则该反应的热化学方程式是 。
参考答案:(1)第2周期ⅣA族
(2) 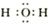
(3)2Na202+2H20=4NaOH+O2
(4)CO2+H20+Na2SiO3=Na2CO3+H2Si03(胶体)
(5)SiH4(g)+202(g)=Si02(s)+2H2O(l) AH=一1520.0 kJ/mol
本题解析:Y原子最外层电子数是次外层的2倍可以确定Y元素是C,Q的单质是常见的半导体材料则Q为Si,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,常见的此类化合物由H2O,H2O2,Na2O,Na2O2可以判断X是H,Z是O,W是Na;
(1)?C在周期表中的位置是第2周期ⅣA族
(2)?X2Z是H2O,电子式是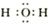
 (3)过氧化钠与水反应的方程式为2Na202+2H20=4NaOH+O2
(3)过氧化钠与水反应的方程式为2Na202+2H20=4NaOH+O2
(4)碳元素和硅元素位于同一主族,证明二者的非金属性强弱可以通过最高氧化物对应水化物的酸性大小进行比较,CO2+H20+Na2SiO3=Na2CO3+H2Si03(胶体),碳酸的酸性比硅酸强,说明碳的非金属性比硅强。
(5)Q的气态氢化物是SiH4,在氧气中燃烧时转移1mol e-放热190.0 kJ则可以得到有1mol SiH4参与反应时放出的热量为1520.0 kJ,所以热化学方程式为SiH4(g)+202(g)=Si02(s)+2H2O(l) AH=一1520.0 kJ/mol。
本题难度:一般
5、选择题 下列微粒中半径最小的是(?)
A.Na
B.Na+
C.Mg2+
D.K
参考答案:C
本题解析:微粒半径主要由电子层数及核电荷数来决定
本题难度:一般