1、选择题 在最外层电子排布为:①3s23p5?②2s22p2?③3s23p4?④3s23p3的几种元素中,其最高氧化物对应水化物的酸性由强到弱的顺序是(? )
A.②③④①
B.①③④②
C.②④③①
D.①②③④
参考答案:B
本题解析:由题知:①为Cl,②为C,③为S,④为P,有非金属性①>③>④>②故其最高氧化物对应水化物的酸性有:①>③>④>②。
本题难度:一般
2、填空题 (选修—物质结构与性质)(12分)
X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43。其中,Y原子的最外层电子数是次外层电子数的三倍。X、Y元素的单质都是构成空气的主要成分。
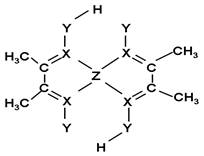
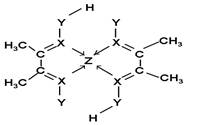
(1)Z原子的价层电子排布式为____________;XY3-离子的空间构型为__________。
(2)X单质与Y单质直接发生化合反应的化学方程式_________________________。
(3)ZO(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO_____?FeO(填“<”或“>” )。
(4)ZO晶体中Z2+的配位数为____________。
(5)化合物A常用于检验Z2+:在稀氨水介质中,A与Z2+
反应可生成鲜红色沉淀,其结构如图所示:
该结构中,碳碳之间的共价键类型是______(“σ键”
或“π键”);X与Z2+离子间形成的是配位键,在图
上标出配位键的电子给予的方向。
该结构中,Y原子与氢原子除了形成共价键外,
还可存在_______?;
该结构中,碳原子的杂化轨道类型有_____;Y原子的杂化轨道类型为_____。
参考答案:
本题解析:(1)由题意可知:X、Y、Z对应的元素分别为:N、O、Ni;Z原子的价层电子排布式为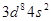 ;XY3-离子为
;XY3-离子为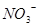 ,空间构型为平面三角形;
,空间构型为平面三角形;
(2)X单质与Y单质直接发生化合反应的化学方程式: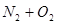
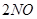 ;
;
(3)(氧化物)、FeO晶体结构类型均与NaCl的相同,Z2+和Fe2+离子半径分别为69pm和78pm,则熔点ZO大于FeO;
(4)ZO晶体中Z2+的配位数为6;
(5)碳碳之间的共价键类型是σ键;Y原子与氢原子除了形成共价键外,还可存在氢键,该结构中,碳原子的杂化轨道类型有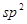 和
和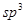 杂化;Y原子的杂化轨道类型为
杂化;Y原子的杂化轨道类型为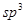 杂化;
杂化;
本题难度:一般
3、选择题 下列说法中正确的是( )
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
B.Fe3+的最外层电子排布式为:3s23p63d5
C.基态铜原子的轨道表示式
D.基态碳原子的轨道表示式
参考答案:B
本题解析:核外电子排布为1s2的原子是He,核外电子排布是1s22s2的为铍(Be),He是惰性元素,Be是金属元素,显然化学性质不相似,A错;Fe的价电子排布为3d64s2,失去电子时先失最外层,再失次外层,失去2个电子变成Fe2+时最外层电子排布为3s23p63d6,失去3个电子变成Fe3+时,最外层电子排布为3s23p63d5,B正确;基态铜原子的轨道表示式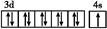 ,符合3d全充满时能量最低,即洪特规则特例,C错;基态碳原子是2s比2p轨道能量低,先填满2s再填2p,即
,符合3d全充满时能量最低,即洪特规则特例,C错;基态碳原子是2s比2p轨道能量低,先填满2s再填2p,即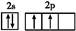 ,不存在半充满能量低的问题,D错。
,不存在半充满能量低的问题,D错。
本题难度:一般
4、选择题 下列离子化合物的电子式书写不正确的是(?)
A.CaCl2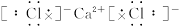
B.Na2S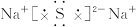
C.KF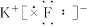
D.Na2O2
参考答案:D
本题解析:离子化合物由阴、阳离子构成。阳离子除 写
写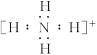 ,其余写离子,而阴离子电子式中达8电子稳定结构(H-为2电子稳定结构)并且用“[?]”,A、B、C三项正确,D项错。
,其余写离子,而阴离子电子式中达8电子稳定结构(H-为2电子稳定结构)并且用“[?]”,A、B、C三项正确,D项错。
本题难度:简单
5、填空题 根据表中信息回答下列问题。
元素
| Si
| P
| S
| Cl
|
单质与氢气
反应的条件
| 高温
| 磷蒸气与氢气能反应
| 加热
| 光照或点燃时发生爆炸而化合
|
?
(1)S在元素周期表中的位置是?。
(2)根据表中信息可知,Si、P、S、Cl 四种元素的的非金属性依次增强。用原子结构解释原因:同周期元素电子层数相同,从左至右,?,原子半径逐渐减小,得电子能力逐渐增强。
(3)25℃时,以上四种元素的单质与氢气反应生成l mol气态氢化物的反应热如下:
a.+34.3 kJ·mol-1? b.+9.3 kJ·mol-1? c.?20.6 kJ·mol-1? d.?92.3 kJ·mol-1
请写出固态白磷(P4)与H2反应生成气态氢化物的热化学方程式?。
(4)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。已知硒(Se)是人体必需的微量元素,其部分信息如图。
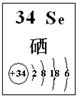
①下列有关说法正确的是?(填字母)。
a. 原子半径:Se>S>P? b. 稳定性:H2Se>H2S
c. 因为酸性H2Se<HCl,所以非金属性Se<Cl
d. SeO2是酸性氧化物,能与烧碱溶液反应
②在下表中列出对H2SeO3各种不同化学性质的推测,举例并写出相应的化学方程式。
编号
| 性质推测
| 化学方程式
|
1
| 氧化性
| H2SeO3+4HI=Se↓+2I2+3H2O
|
2
| ?
| ?
|
3
| ?
| ?
|
?
参考答案:(1)第3周期VIA(2)核电荷数逐渐增大(或质子数)
(3)P4(s)+6H2(g)=4PH3(g)?△H=+37.2 kJ·mol-1
(4)①d
②
1
性质预测
化学方程式
2
还原性
H2SeO3+Cl2+H2O=" " H2SeO4+2HCl
3
酸性
H2SeO3+2NaOH=Na2 SeO3+2H2O.
本题解析:(1)、(2)参见答案;(3)先写出固态白磷(P4)与H2反应生成气态氢化物的化学方程式:P4+6H2=4PH3,通过化学方程式看以看出,1mol P4与H2反应生成4 mol PH3,根据题设条件,当反应生成4 mol PH3时,则反应放出的热量为:4×+9.3 kJ·mol-1=+37.2 kJ·mol-1?,所以热化学方程式为:
P4(s)+6H2(g)=4PH3(g)?△H=+37.2 kJ·mol-1(4)①a.根据同周期和同主族元素原子半径的递变规律,可知正确关系应为:Se>P>S;错误;b.同主族元素气态氢化物的稳定性自上而下依次减弱,正确的应为: H2Se<H2S ,错误;c.应当为最高价氧化物对应的水化物的酸性,即:H2SeO4<HClO4,则非金属性Se<Cl,错误;d.根据同主族元素的性质的相似性,不难得知d正确。
(4)研究H2SeO3的化学性质可从H2SO3的化学性质进行类推,亚硫酸有还原性,能与氯气发生反应,由此可推断H2SeO3也有还原性,化学方程为: H2SeO3+Cl2+H2O= H2SeO4+2HCl;亚硫酸有酸性,能与碱发生反应:则可类推H2SeO3也由此性质,化学方程式为:H2SeO3+2NaOH=Na2 SeO3+2H2O.
本题难度:一般