1、选择题 除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是
[? ]
A.?AgNO3,?Na2CO3,?HNO3
B.?Na2CO3,?AgNO3,?HNO3
C.?AgNO3,?K2CO3,?HNO3
D.?AgNO3,?Na2CO3,?HCl
参考答案:A
本题解析:
本题难度:一般
2、填空题 将煤焦油中的苯、甲苯和苯酚进行分离,可采取如下图示方法和操作:
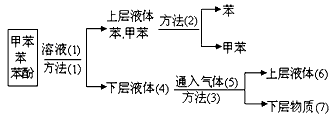
(1)写出物质(1)和(5)的化学式:(1)___________;(5)___________;
(2)写出分离方法(1)和(2)的名称:(1)___________;(2)__________;
(3)混合物加入溶液(1)反应的化学方程式____________________________。
参考答案:(1)NaOH;CO2
(2)分液;蒸馏
(3)C6H5OH + NaOH→C6H5ONa + H2O
本题解析:
本题难度:一般
3、简答题 空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下:
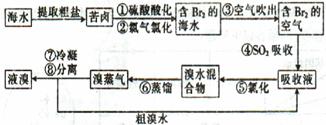
(1)目前,从海水中提取的溴约占世界溴年产量的?。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是?。
(3)步骤④的离子方程式。?
(4)步骤⑥的蒸馏过程中,溴出口温度要控制在80?90℃。温度过高或过低都不利于生产,理由是?。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是??,分离吋液溴从分离器的??(填“上口”或“下口”)排出。
(6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”的原因是??。
(7)某同学测得苦卤中溴的含量为0.8g·L-1,已知步骤①?⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴?mol。
参考答案:
(1)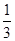
(2)酸化可抑制Cl2、Br2与水反应
(3)Br2+SO2+2H2O==4H++2Br-+SO42-
(4)温度过高,大量水蒸气随水排出去,溴蒸气中水分增加,温度过低,溴不能完全蒸出,吸收率低。
(5)分液漏斗;下口
(6)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氯化”的过程实际是一个溴的浓缩过程。
(7)33.75
本题解析:(1)从海水中提取的溴约占世界溴年产量的 。
。
(2)Cl2、Br2与水反应生成酸,加入硫酸可抑制Cl2、Br2与水反应。
(3)步骤④是溴单质将SO2氧化。
(4)温度过高,会增加水蒸气,温度过低,则溴不能完全蒸出。
(5)分离溴水和液溴,应用分液漏斗。因液溴密度大于水,因此液溴从分液漏斗下口排出。
(6)氯化后的海水含溴量低。
(7)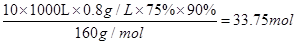 。
。
本题难度:一般
4、选择题 实验室进行Na2SO4溶液蒸发时,一般有下列操作过程,其正确的操作顺序为:①固定铁圈位置?②停止加热,余热蒸干?③放置酒精灯?④放蒸发皿?⑤加热搅拌( )
A.①③④⑤②
B.③①④⑤②
C.①④③⑤②
D.③④①⑤②
参考答案:B
本题解析:
本题难度:简单
5、选择题 除去镁粉中混有的少量铝粉,可选用的试剂是
[? ]
A.稀盐酸?
B.稀硫酸
C.氢氧化钠溶液?
D.氨水
参考答案:C
本题解析:
本题难度:一般