|
|
|
高中化学知识点讲解《热化学方程式》试题预测(2017年最新版)(九)
2018-03-17 05:54:13
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 已知常温时红磷比白磷稳定,在下列反应中
P4(白磷,s)+5O2(g) =2P2O5(s) △H= -akJ/mol
4P(红磷,s)+5O2(g) =2P2O5(s) △H= -bkJ/mol
若a、b均大于零,则a和b的关系为
[? ]
A.a>b
B.a=b
C.a<b
D.无法确定
2、选择题 已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s) △H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H= -3119.91kJ/mol
由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.3O2(g)=2O3 (g)△H=285.0 kJ/mol
D.O3比O2稳定,由O2变O3 为吸热反应
|
3、选择题 298K、10lkPa时,1molH2(g)与O2(g)完全反应生成H2O(g)时放出242kJ热量,而生成H2O(1)时放出286kJ热量,则下列表达不正确的是( )
A.2H2(g)+O2(g)=2H2O(g);△H=-484kJ?mol-1
B.H2O(g)=H2(g)+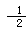 O2(g);△H=242kJ?mol-1 O2(g);△H=242kJ?mol-1
C.H2(g)+ O2(g)=H2O(1);△H=-286kJ?mol-1 O2(g)=H2O(1);△H=-286kJ?mol-1
D.H2O(1)=H2O(g);△H=-44kJ?mol-1
4、选择题 已知常温时红磷比白磷稳定,在下列反应中:
4P(白磷,s)+5O2(g)====2P2O5(s);△H= -a kJ/mol
4P(红磷,s)+5O2(g)====2P2O5(s);△H= -b kJ/mol
若a、b均大于零,则a和b的关系为
A.a<b
B.a=b
C.a>b
D.无法确定
|
5、选择题 下列说法或表示方法正确的是
[? ]
A、需要加热发生的反应是吸热反应
B、在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5mol?H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C、由C(石墨)→C(金刚石);△H=+1.73?kJ/mol,可知金刚石比石墨稳定
D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8kJ/mol