1、填空题 合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。?可以生产被称为21世纪的新型燃料——甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:
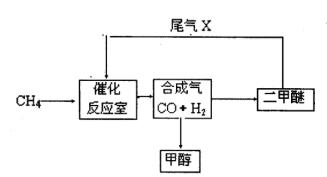
(1)写出用合成气生产二甲醚的化学方程式?。
 ?(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)? CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式?。
?(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)? CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式?。
(3)工业上一般采用下列两种反应合成甲醇:
 反应Ⅰ: CO(g)+2H2(g)? CH3OH(g)?
反应Ⅰ: CO(g)+2H2(g)? CH3OH(g)?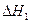
 反应Ⅱ:CO2(g)+3H2(g)? CH3(g)+H2O(g)
反应Ⅱ:CO2(g)+3H2(g)? CH3(g)+H2O(g)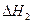
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度
| 250
| 300
| 350
|
K
| 2.041
| 0.270
| 0.012
|
由表中数据判断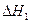 ?0(填“>”、“=”、“<”)。
?0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+ O2(g)
O2(g)?CO2(g)+2H2(g)?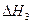 =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+ O2(g)
O2(g)?H2O(g)?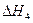 =-241.8kJ·mol-1
=-241.8kJ·mol-1
则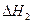 =?。
=?。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式?。
参考答案:(1)①2CO+4H2?CH3OCH3+H2O?3分
(2)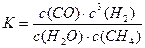 (其它合理表达也给分)? 2分
(其它合理表达也给分)? 2分
(3)① <? 2分?②-48.9kJ·mol-1?3分
(4)CH3OCH3+160H一一12e一?2CO23一+11H2O? 3分
本题解析:略
本题难度:一般
2、选择题 在恒温恒压的密闭容器中,充入?4L?X和3L?Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)?2Q(g)+nR(g)达到平衡时测得?X的转化率为25%,此时混合气体的体积为6.5L.则该反应方程式中的n值是( )
A.8
B.6
C.5
D.3
参考答案:在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)?2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L.依据平衡的三段式计算列式计算得到:
? ? ? 4X(g)+3Y(g)?2Q(g)+nR(g)
起始量(L)? 4? 3? 0?0?
变化量(L)?4×25%=1? 34? 12?14n
平衡量(L)? 3? ? 94? 12? ? 14n
则得到:3+94+12+n4=6.5
n=3
故选D.
本题解析:
本题难度:简单
3、填空题 在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
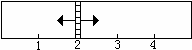
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
参考答案:(1)逆反应? 1.25<x<1.75?(2)正反应 ?25%
本题解析:(1)这两个平衡体系的特点是:第一个反应前后气体的总物质的量发生变化,第二个保持不变,故右边永远是9mol气体,同在一个容器中,同温同压,故气体的物质的量之比等于体积之比。故平衡时,左边为6mol气体;当x=1.5时,左边现在总的物质的量为5.75mol<6mol,故向逆反应方向进行;若保持该方向,1.25<x<1.75;
(2)根据上述,反应向正反应方向进行了

平衡总物质的量为6mol,即 2-2y+3.25-y +1+2y= 6mol,解之,得y =0.25mol,2-2y? =1.5,二氧化硫的体积分数="1.5/6=25%" ;
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。
本题难度:困难
4、选择题 下列事实能用勒夏特列原理来解释的是
A.由H2、I2、HI组成的平衡体系加压后颜色变深
B.黄绿色的氯水光照后颜色变浅
C.使用催化剂可加快SO2转化为SO3的速率
D.将木炭粉碎后与O2反应,速率更快
参考答案:B
本题解析:
答案:B
A.由H2、I2、HI组成的平衡体系是反应前后,分子数不变的反应,加压后颜色变深,是物理变化。
B.黄绿色的氯水光照后颜色变浅,是HClO见光分解了,使Cl2+H2O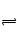 HCl+HClO平衡正向移动。
HCl+HClO平衡正向移动。
C.使用催化剂同等程度加快正逆反应的速率
D.将木炭粉碎后与O2反应,增大接触面积,速率更快
本题难度:一般
5、选择题 在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)?△H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
Fe(s)+CO2(g)?△H="a" kJ/mol(a >0),该温度下K=0.263,下列有关该反应的说法正确的是
A.若生成1 mol Fe,则吸收的热量小于a kJ
B.若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动
C.若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态
D.达到化学平衡状态时,若c(CO)="0.100" mol/L,则c(CO2)="0.0263" mol/L
参考答案:D
本题解析:若生成1 mol Fe,则根据热化学方程式可知,吸收的热量是akJ,选项A不正确;升高温度正逆反应速率都是增大的,选项B不正确;反应前后体积不变,因此压强始终是不变的,C不正确;根据平衡常数可知,选项D正确,答案选D。
本题难度:一般