1、填空题 每空2分,共10分)
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
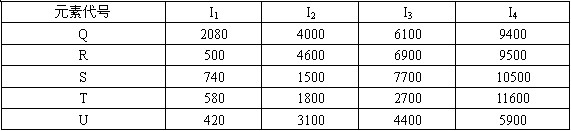
(1)在周期表中,最可能处于同一族的是(?)
A.Q和R? B.S和T? C.T和U? D.R和T? E.R和U
(2)电解它们的熔融氯化物或氧化物,阴极电极反应式最可能正确的是(?)
A.Q2++2e-→Q? B.R2++2e-→R? C.S3++3e-→S
D.T3++3e-→T?E.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是(?)
A.QCl2? B.RCl? C.SCl3? D.TCl? E.UCl4
(4)S元素最可能是(?)
A.S区元素? B.稀有气体元素? C.p区元素? D.准金属? E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是(?)
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1)E?氦(1s2)
参考答案:(1)E(2)D(3)B(4)A(5)E
本题解析:(1)同一主族,化学性质具有相似性,电离螚相差不大,而且电离能随金属性增强而减小,故E组R和U;
(2)根据电离能数据可知T的第一、第二、第三电离能相差不大,故可以失去3个电子生成T3+,故在阴极发生还原反应,T3++3e- →T,R和U第一电离能很小,第二电离能很大,故容易失去1个电子;S第三电离能很大,容易失去2个电子;Q电离能很大,不容易失电子;
(3)可能形成的氯化物为A.QCl3 B.RCl C.SCl2 D.TCl3 E.UCl,故选择B项;
(4)S第三电离能很大,所以容易失去2个电子,故电子排布可能为ns2,所以可能属于S区元素;
(5)Q电离能很大,不容易失电子,属于化学性质和物理性质最像Q元素是惰性气体氦(1s2);
本题难度:简单
2、选择题 下列说法正确的是
A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.同周期非金属氧化物对应水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
参考答案:B
本题解析:A不正确,应该是同一周期的ⅠA族元素的金属性比ⅡA族元素的金属性强;C不正确,应该是同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强;D不正确,第三周期元素的阳离子半径小于后面阴离子半径,答案选B。
点评:该题是中等难度的试题,试题基础性强,贴近高考,难易适中。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:简单
3、选择题 在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是(?)
A.原子序数:Z>Y>X>W
B.X、Y、Z、W形成的单质最多有6种
C.X元素最高价氧化物对应水化物的化学式为:H3 XO4
D.四种元素的气态氢化物中,W的气态氢化物最稳定
参考答案:A
本题解析:略
本题难度:一般
4、选择题 某元素的一个原子形成的离子可表示为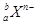 ,下列说法正确的是
,下列说法正确的是
A.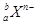 含有的中子数为a+b
含有的中子数为a+b
B.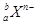 含有的电子数为a-n
含有的电子数为a-n
C.X原子的质量数为a+b+n
D.X原子的质量约为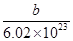 g
g
参考答案:D
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以A、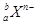 含有的中子数为b-a,A不正确;B、质子数=核外电子数,则该微粒的电子数=a+n,B不正确;C、X原子的质量数为b,C不正确;D、由于X原子的质量数为b,则1mol该原子的质量是bg。由于1mol该原子含有的原子个数是6.02×1023,所以X原子的质量约为
含有的中子数为b-a,A不正确;B、质子数=核外电子数,则该微粒的电子数=a+n,B不正确;C、X原子的质量数为b,C不正确;D、由于X原子的质量数为b,则1mol该原子的质量是bg。由于1mol该原子含有的原子个数是6.02×1023,所以X原子的质量约为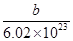 g,D正确,答案选D。
g,D正确,答案选D。
本题难度:一般
5、计算题 某元素的同位素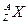 ,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
,它的氯化物XCl21.11 g溶于水制成溶液后,加入1 mol·L-1的AgNO3溶液20 mL恰好完全反应。若这种同位素原子核内有20个中子。求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
(3)把X的单质放入水中,有何现象?写出反应的化学方程式。
参考答案:
(1) =20,
=20, =40。(2)第四周期,ⅡA族。(3)有气泡产生。Ca+2H2O
=40。(2)第四周期,ⅡA族。(3)有气泡产生。Ca+2H2O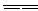 Ca(OH)2+H2↑。
Ca(OH)2+H2↑。
本题解析:
Ag++Cl-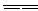 AgCl
AgCl
1 1?
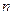 ?(Ag+)="1" mol·L-1×0.02 L
?(Ag+)="1" mol·L-1×0.02 L
所以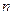 (Cl-)=" 0.02" mol
(Cl-)=" 0.02" mol
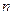 (XCl2)=" 0.01" mol
(XCl2)=" 0.01" mol
 (XCl2)=" 111" g·mol-1
(XCl2)=" 111" g·mol-1
 (X)= 111-71=40
(X)= 111-71=40
则 =40,
=40, =20,该元素是Ca
=20,该元素是Ca
本题难度:一般