1、选择题 下列物质中可用于治疗胃酸过多的是
[? ]
A.碳酸钠
B.氢氧化铝
C.氧化钙
D.碳酸钡
参考答案:B
本题解析:
本题难度:简单
2、填空题 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质。从铝土矿中提炼Al2O3的流程如下:

回答下列问题:
(1)写出反应1的化学方程式?;
(2)滤液Ⅰ中加入CaO生成的沉淀是?,反应2的离子方程式为?;
(3)电解制铝的化学方程式是?,以石墨为电极,阳极产生的混合气体的成分是?。
参考答案:(1)2NaOH+SiO2=Na2SiO3+H2O(2分) 2NaOH+Al2O3=2NaAlO2+H2O(2分)
(2)CaSiO3(1分)?
?2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-?或AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)
(3)2Al2O3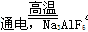 4Al+3O2↑(2分) ?O2、CO2(CO)(2分)
4Al+3O2↑(2分) ?O2、CO2(CO)(2分)
本题解析:(1)酸性氧化物、两性氧化物都能溶于强碱溶液,生成盐和水;(2)氧化钙是碱性氧化物,与水反应生成氢氧化钙,钙离子与硅酸根离子结合成硅酸钙沉淀;偏铝酸盐溶液通入少量或过量CO2,可以制取氢氧化铝沉淀;(3)电解熔融氧化铝可制取铝;阳极反应式为2O2——2e—=O2↑,高温下C与O2反应生成CO2或CO。
本题难度:一般
3、选择题 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比为
A.3:2
B.2:3
C.1:3
D.1:1
参考答案:D
本题解析:由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,酸、碱均过量,则铝完全反应,铝的物质的量相等,从方程式中可以看到铝与氢气的比例都是2:3,因此产生的氢气是相等的,生成氢气的体积比为1:1,答案选D。
本题难度:一般
4、填空题 某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是?。
⑵AlO(OH)与NaOH反应的化学方程式为?。
⑶在稀释、结晶过程中:稀释的目的是?;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的?气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:?。
⑸该生产流程能实现?(填化学式)的循环利用。
参考答案:
⑴加快反应的速率
⑵AlO(OH) +NaOH=NaAlO2+H2O
⑶促进NaAlO2的水解? CO2
⑷Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑸NaOH
本题解析:(1)高温有利于加快反应速率;(2)AlO(OH)与NaOH反应的同样应是偏铝酸钠,AlO(OH) +NaOH=NaAlO2+H2O;(3)该过程是通过NaAlO2的稀释生成Al(OH)3,没有其它反应物,故其应该是水解产生,稀释促进NaAlO2的水解,也可以用CO2与其反应利用强酸制弱酸生成氢氧化铝;(4)加入熟石灰生成碳酸钙除去;(5)NaOH碱浸时使用,最后过滤时产生,故是循环利用。
本题难度:一般
5、选择题 利用下图装置做铝热反应实验。下列说法不正确的是
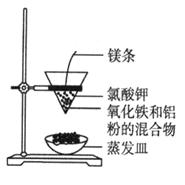
A.该反应的化学方程式是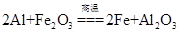
B.该反应会产生高温、发出强光
C.根据铝热反应的原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
参考答案:D
本题解析:A、Al与Fe2O3在高温条件下反应,生成Fe和Al2O3,正确;B、铝热反应会放出大量的热,产生高温、发出强光,正确;C、铝热反应可以生成金属单质,利用铝热反应可冶炼某些金属,正确;D、铁元素的化合价从+3价降低到0价,因此1mol氧化铁在反应中得到6mol电子,若反应中转移3 mol电子,则消耗氧化剂的物质的量是0.5 mol,错误。
本题难度:一般