1、选择题 元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。若发现117号元素,请您在元素大厦中安排好它的“房间”
A.第七周期第0族
B.第六周期ⅡA族
C.第八周期第ⅠA族
D.第七周期第ⅦA族
参考答案:D
本题解析:根据个周期的元素种数(第一至第七分别有2、8、8、18、18、32、32种元素)知第七周期末为118号元素,则该元素在第七周期第ⅦA族, D正确。
本题难度:简单
2、选择题 原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。
(1)已知铱的一种同位素是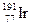 ,则其核内中子数是
,则其核内中子数是
A.77? B.114? C.191?D.268?
(2)已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为
A.39︰61? B.61︰39? C.1︰1? D.39︰11
参考答案:(1)B?(2)A.
本题解析:(1)主要考查质量数、质子数、中子数之间的关系,运用“中子数=质量数-质子数”即可得到答案;(2)主要考查学生对教材基础知识即平均相对原子质量的计算公式的熟练掌握程度。解法1.概念公式法:设原子个数比?191Ir :?193Ir =x:y
则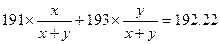 ,解得? x:y=39:61
,解得? x:y=39:61
解法2:用十字交叉法快速求解:

 ?191Ir? 191? 0.78? 39
?191Ir? 191? 0.78? 39



 ? 192.22? =
? 192.22? =
193Ir? 193?1.22? 61
解法3:观察排除法:平均原子量大于191与193的中间值192,可以判断出质量数大的原子含量高,故191Ir : 193Ir<1:1,只有选项A符合。
本题难度:一般
3、填空题 (18分)推断题:
现有10种元素的性质、数据如下表所列,它们均为短周期元素。
?
| A
| B
| C
| D
| E
| F
| G
| H
| I
| J
|
原子半径(10-10m)
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
| 0.82
| 1.02
| 0.37
|
最高或最低化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
| +3
| +6
| +1
|
-2
| ?
| ?
| -3
| -1
| ?
| -3
| ?
| -2
| ?
|
回答下列问题:
(1)D的元素名称是?,H的元素符号是?。
B在元素周期表中的位置是(周期、族)?。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的化学式是?。
化合物F2A2的电子式是:?,构成该物质的化学键类型为?。
(3)用电子式表示A的最简单氢化物的形成过程:??;G的气态氢化物的结构式为?。
(4)一定条件下,IA2气体与足量的气体A2充分反应生成20gIA3气体,放出24.6 kJ热量,写出其热化学方程式??。
参考答案:(1)磷(2分)、B(2分)、第三来源:91考试 网周期第ⅡA族?(2分)
(2)HClO4(2分)?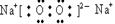 ?(2分)?离子键、非极性键(2分)
?(2分)?离子键、非极性键(2分)
(3)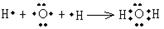 (2分)?
(2分)?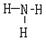 (2分)
(2分)
(4)2SO2 (g)+O2(g) 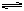 ?2SO3(g)?△H =-196.8 kJ/mol(2分)
?2SO3(g)?△H =-196.8 kJ/mol(2分)
本题解析:根据原子半径及化合物的规律,可推知A~J十种元素分别为:O、Mg、Na、P、Cl、Na、N、B、S、Li;
本题重点考查了元素周期律的应用及化学用语的书写,需要的是细心,但难度不大。详解见答案。
本题难度:一般
4、填空题 (12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。

参考答案:(12分)
(1) (2分)
(2分)
(2)S<O<N (2分)?
(3)sp3?(2分)
(4)H2O与H2O2之间形成氢键(2分)
(5)[Ni(NH3)6]SO4(2分)
(6)2∶3(2分)
本题解析:B元素原子最外层电子数比内层多3个,则B为N元素;C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则E为Ni元素。
(1)E为Ni元素,基态原子的外围电子排布图为: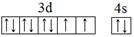
(2)元素B、C、D分别为N、O、S,N原子2p能级排布了3个电子,为半充满状态,较稳定,第一电离能大于O,所以第一电离能由小到大排列顺序为:S<O<N
(3)DC3冷凝可形成一种D、C相间的六元环结构的三聚体,则六元环上3个S和3个O依次交替,每个S再连接2个O,则每个S形成4个σ键,所以S原子的杂化方式为sp3
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,则A为H元素,两种化合物分别为H2O、H2O2,H2O与H2O2之间形成氢键,所以两种化合物可任意比互溶。
(5)A、B、C、D、E五种元素组成某配位化合物X,根据其原子个数比为18:6:4:1:1,可得化学式为:[Ni(NH3)6]SO4
(6)根据切割法,Sb位于公共边上,所以1个环含有Sb:4×1/2=2;位于上下顶点上的O只属于1个环,位于公共边上的O为2个环共用,所以1个环含有O:2×1/2+2=3,因此该分子中Sb和O的原子个数比为2:3。
本题难度:一般
5、选择题 下列叙述正确的是
A.吸热反应需要加热才能发生
B.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
C.将钾投入到氯化铝溶液中,能置换出单质铝
D.砹在第6周期ⅦA族;根据元素周期律推断出它是一种有色固体,它的气态氢化