1、选择题 短周期的A、B两种元素,A原子半径小于B的原子半径,两种元素可形成A是正价的AB2型化合物。下列关于两元素的叙述正确的是?
①A、B可能属于同一周期②A是B的前一周期元素;
③A只能是金属元素;?④A可能是第二周期IIA族或IVA族元素
A.①③? B.②③? C.②④? D.②③④
参考答案:C
本题解析:略
本题难度:简单
2、填空题 ( 14分)
14分)
电子总数均为14的微粒有X、Y、Z、Q、R、W 6种,按要求填空:
(1)x、Y为两种单质,X的氧化物是制造光导纤维的主要原料,X的 晶体类型为?,该氧化物的化学式为?;Y为分子晶体,其电子式为?。
晶体类型为?,该氧化物的化学式为?;Y为分子晶体,其电子式为?。
(2)Z分子中含有4个原子,其分子的空间构型是?。
(3)Q为低价氧化物,请写出有Q生成的置换反应?。
(4)R为-2价阴离子,请写出R与钙离子组成的离子化合物与水反应的化学方程式?。
(5)W为两种相邻元素构成的-1价阴离子,其钠盐水溶液显碱性的原因是?。(用离子方程式表示)。
参考答案:
(1)原子晶体(2分);Si2(2分);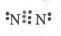 ?(2分)?
?(2分)?
(2)直线型(2分)
(3)C+H2O

(4)CaC2+2H2O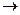 Ca(OH)2+C2H2↑(2分)?
Ca(OH)2+C2H2↑(2分)?
(5)CN++H2O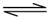 HCN+OH-(2分)
HCN+OH-(2分)
本题解析:略
本题难度:简单
3、选择题 下列叙述不正确的是
A.NaOH的碱性介于KOH和Mg(OH)2之间
B.Li、Na、K、Rb元素金属性依次增强
C.Na+、Mg2+、Al3+的离子半径依次增大
D.H2SiO3、H2CO3、HClO4酸性依次增强
参考答案:C
本题解析:
答案:C
A、正确,金属性K>Na>Mg, NaOH的碱性介于KOH和Mg(OH)2之间;B.正确,Li、Na、K、Rb原子半径依次增大,元素金属性依次增强;C、不正确,核外电子层结构相同时,核电荷数大,半径反而小,Na+、Mg2+、Al3+的离子半径依次减小;D.正确,非金属性Si <C<Cl,H2SiO3、H2CO3、HClO4酸性依次增强。
本题难度:一般
4、选择题 下列分子中所有的原子都满足最外层为8电子结构的是(B? )
A.BCl3
B.COCl2
C.SF6
D.SiH4
参考答案:B
本题解析:只要分子中元素化合价的绝对值和最外层电子数之和满足8就能满足最外层为8电子结构,B中碳是+4价、氧是-2价,氯是-1价,所以选项B正确,A中B,C中S,D中H都不能满足最外层为8电子结构,答案选B。
本题难度:简单
5、选择题 运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸
C.硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体
参考答案:D
本题解析:D选项,硒的半径比硫的要大。而稳定性应从原子半径进行比较,半径越小越稳定,所以H2S较稳定。故D选项是错误的。
本题难度:一般