1、实验题 镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题。
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是?。
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为?。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为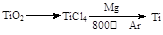
金属镁的作用为?,在Ar气氛中的进行的理由是?。
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知:
Mg+H2O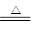 MgO+H2↑?Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑?Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示。

①导管口间的连接次序是:a →( )()→()()→()()→ h
②通气后,应先点燃?(填“B”或“C”)装置的酒精灯,装置A的作用是?,装置E的作用是?。
③请设计一个简单的小实验验证产物是氮化镁?。
参考答案:(1)MgO熔点很高,能耗太大
(2)2Mg+CO2 2MgO+C
2MgO+C
(3)作还原剂?氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)作用
(4)①a →( g )( f )→ ( d )( e )→( b )( c )→ h
②C?除去空气中的CO2?防止空气中的水蒸气进入与Mg3N2反应
③取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
本题解析:(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是MgO熔点很高,能耗太大。(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为2Mg+CO2 2MgO+C。(3)?金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)。(4)①制备氮化镁(Mg3N2)要除去氧气和水蒸气的干扰,故连接顺序为a →( g )( f )→ ( d )( e )→( b )( c )→ h 。②通气后,应先点燃C装置的酒精灯确保把氧气除干净,装置A的作用是除去空气中的CO2。,装置E的作用是防止空气中的水蒸气进入与Mg3N2反应。 ?③由于氮化镁与水反应后能放出氨气,可以通过检测氨气的生成来测定是否有氮化镁。方法为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
2MgO+C。(3)?金属镁的作用为作还原剂。在Ar气氛中的进行的理由是氩气作保护气,防止高温下Mg(或Ti)在空气中的O2(CO2或N2)。(4)①制备氮化镁(Mg3N2)要除去氧气和水蒸气的干扰,故连接顺序为a →( g )( f )→ ( d )( e )→( b )( c )→ h 。②通气后,应先点燃C装置的酒精灯确保把氧气除干净,装置A的作用是除去空气中的CO2。,装置E的作用是防止空气中的水蒸气进入与Mg3N2反应。 ?③由于氮化镁与水反应后能放出氨气,可以通过检测氨气的生成来测定是否有氮化镁。方法为:取少量产物置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,如果能够看到润湿的红色石蕊试纸变蓝,则说明产物是氮化镁。
本题难度:一般
2、选择题 某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是(?)
A.Cl― NO3― Ba2+ Fe3+
B.SO42― S2― Al3+ Mg2+
C.Na+ K+ SO42― Cl―
D.NH4+ Ba2+ Cl― HCO3―
参考答案:C
本题解析:略
本题难度:简单
3、选择题 关于下列金属氧化物的用途中,说法正确的是
[? ]
A.氧化铁是一种红棕色的粉末,能与氢氧化钠溶液反应,常用于制造红色油漆和涂料
B.氧化铝是一种白色难熔的物质,是较好的耐火材料,常用于制造耐火坩埚和耐火管
C.氧化铜呈黑色,能溶于水,可作为制造铜盐的原料
D.氧化亚铜呈蓝色,可作为制造玻璃、搪瓷的颜料
参考答案:B
本题解析:
本题难度:简单
4、填空题 如图所示:
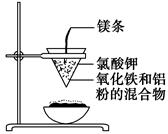
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
参考答案:(1)2Al+Fe2O3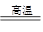 2Fe+Al2O3 Fe2O3 Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾分解 引发铝热反应
2Fe+Al2O3 Fe2O3 Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止溅落物炸裂蒸发皿 引起氯酸钾分解 引发铝热反应
本题解析:(1)铝热反应为2Al+Fe2O3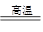 2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
2Fe+Al2O3,该反应中Fe2O3作氧化剂,Al作还原剂。
(2)①②③④全为该铝热反应的现象。
(3)铝热反应实验中①为使熔融物易落下通常在内层纸漏斗底部剪一个孔;②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙子;③反应中镁条引起氯酸钾分解;④氯酸钾引发铝热反应。
本题难度:简单
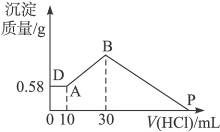
5、计算题 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58 g白色难溶物析出,向所得溶液中逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如右图所示:
(1)混合物中NaOH的质量是___________g,AlCl3的质量是___________g,MgCl2的质量为___________g。
(2)P点表示盐酸加入的体积为___________mL。
参考答案:(1)2.6? 1.335? 0.95?(2)130
本题解析:(1)由图可知,三种物质混合时有0.58 g沉淀,当向此混合物中加入10 mL盐酸时,沉淀质量不变,说明混合物中NaOH过量,该沉淀是Mg(OH)2,由镁元素守恒可知:n(MgCl2)=n〔Mg(OH)2〕=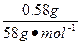 ="0.01" mol,故m(MgCl2)="0.01" mol×95 g·mol-1="0.95" g。由以下关系得:
="0.01" mol,故m(MgCl2)="0.01" mol×95 g·mol-1="0.95" g。由以下关系得:
2NaOH?—? MgCl2—Mg(OH)2
0.02 mol? 0.01 mol
AlCl3?—? NaAlO2—HCl
0.01 mol?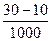 ×0.5 mol·L-1="0.01?" mol
×0.5 mol·L-1="0.01?" mol
m(AlCl3)="0.01" mol×133.5 g·mol-1="1.335" g
由图可知,B点是沉淀量最大点,此时溶液中溶质只有NaCl,由元素守恒可知:
n(NaOH)=n(HCl)+2n(MgCl2)+3n(AlCl3)="0.5" mol·L-1×0.03 L+2×0.01 mol+3×0.01 mol="0.065" mol,所以,m(NaOH)="0.065" mol×40 g·mol-1="2.6" g。
(2)由图可知,P点时Al(OH)3、Mg(OH)2沉淀恰好全部溶解在盐酸中,溶质为NaCl、AlCl3、MgCl2,所以,此时溶解Al(OH)3、Mg(OH)2沉淀恰好消耗盐酸:
V(HCl)=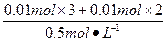 ="0.1" L="100" mL。
="0.1" L="100" mL。
由此可知,P点时,V(HCl)="30" mL+100 mL="130" mL。
本题难度:简单