1、实验题 镁在高温下与O2、N2或CO2均可以发生反应,试解决下列问题。
(1)工业通常采用电解熔融氯化镁冶炼金属镁,不以氧化镁为原料的理由是?。
(2)将燃着的镁条伸入盛满CO2的集气瓶中,镁条剧烈燃烧,发出耀眼的白光,瓶内壁上有黑色物质生成,化学方程式为?。
(3)由金红石(TiO2)制取单质钛(Ti),涉及到的反应步骤为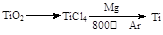
金属镁的作用为?,在Ar气氛中的进行的理由是?。
(4)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知:
Mg+H2O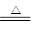 MgO+H2↑?Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
MgO+H2↑?Mg3N2 +6H2O =3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示。

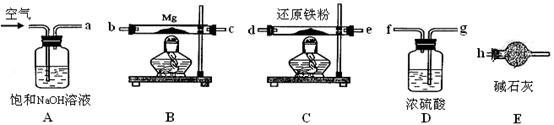
①导管口间的连接次序是:a →( )()→()()→()()→ h
②通气后,应先点燃?(填“B”或“C”)装置的酒精灯,装置A的作用是?,装置E的作用是?。
③请设计一个简单的小实验验证产物是氮化镁?。
2、选择题 某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是(?)
A.Cl― NO3― Ba2+ Fe3+
B.SO42― S2― Al3+ Mg2+
C.Na+ K+ SO42― Cl―
D.NH4+ Ba2+ Cl― HCO3―
3、选择题 关于下列金属氧化物的用途中,说法正确的是
[? ]
A.氧化铁是一种红棕色的粉末,能与氢氧化钠溶液反应,常用于制造红色油漆和涂料
B.氧化铝是一种白色难熔的物质,是较好的耐火材料,常用于制造耐火坩埚和耐火管
C.氧化铜呈黑色,能溶于水,可作为制造铜盐的原料
D.氧化亚铜呈蓝色,可作为制造玻璃、搪瓷的颜料
4、填空题 如图所示:
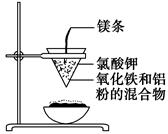
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
5、计算题 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58 g白色难溶物析出,向所得溶液中逐滴加入0.5 mol·L-1的盐酸,加入盐酸的体积和生成沉淀的质量如右图所示:
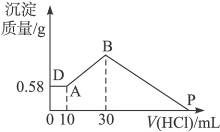
(1)混合物中NaOH的质量是___________g,AlCl3的质量是___________g,MgCl2的质量为___________g。
(2)P点表示盐酸加入的体积为___________mL。