1、选择题 室温时,下列各组离子在指定溶液中可以大量共存的是
A.加入铝片能产生氢气的溶液中:K+、OH-、NO3-、Fe3+
B.无色透明溶液中:K+、Cu2+、SO42-、Na+
C.含有大量AlO2-的溶液中:Na+、OH-、Cl-、CO32-
D.能使pH试纸显红色的溶液中:Na+,NO3-,Fe2+,SO42-
参考答案:C
本题解析:分析:A.加入铝片能产生氢气的溶液,为酸或强碱溶液;
B.Cu2+为蓝色;
C.含有大量AlO2-的溶液,显碱性;
D.能使pH试纸显红色的溶液,显酸性.
解答:A.加入铝片能产生氢气的溶液,为酸或强碱溶液,H+、OH-结合生成水,OH-、Fe3+结合生成沉淀,不能共存,故A错误;
B.Cu2+为蓝色,与无色溶液不符,故B错误;
C.含有大量AlO2-的溶液,显碱性,该组离子之间不反应,能共存,故C正确;
D.能使pH试纸显红色的溶液,显酸性,H+、NO3-、Fe2+发生氧化还原反应,不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确习题中的信息及离子之间的反应即可解答,注意选项D中的氧化还原反应,题目难度不大.
本题难度:简单
2、填空题 (14分)(1)向1 L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为?,AlCl3的物质的量?。
(2)已知:2Fe3++2I- = 2Fe2++ I2; 2Fe2++Br2?= 2Fe3++2Br-
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是 。
②如果向①的溶液中通入3mol Cl2,则被氧化的离子对应的氧化产物分别是 ?。
(3)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n =" 1" : 2.7,?该反应的化学方程式为 __________________________________________________(假设还原产物只有一种,且只生成一种盐)
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________?
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
参考答案:(14分)(1)(4a-3b )/3;b-a? (2)?①I- ?Fe2+?② Fe3+? I2? Br2
(3)① 5Fe +12HNO3=5Fe(NO3)2 + N2↑ + 6H2O ②16.8 ≤ n ≤ 25.2?③N2O或NH4NO3
本题解析:(1)设AlCl3和FeCl3的物质的量分别是x和y,则根据有关反应的化学方程式是AlCl3+3NaOH=Al(OH)3↓+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O可知,3x+3y=amol、x=bmol-amol,解得y= ,所以铁离子的浓度是
,所以铁离子的浓度是 /L。
/L。
(2)①根据氧化还原反应中还原剂的还原性强于还原产物的可知,还原性强弱顺序是I->Fe2+>Br-。2mol氯气得到4mol电子,1mol FeI2失去3mol,所以氯气还能氧化1mol亚铁离子。
②3mol氯气得到6mol电子,溶液中碘离子生成2mol电子,亚铁离子失去2.5mol,所以还能氧化1.5mol溴离子,即氧化产物是Fe3+、I2、Br2。
(3)①铁和硝酸的物质的量之比是 ,所以氧化产物应该是硝酸亚铁,则反应的化学方程式是5Fe +12HNO3=5Fe(NO3)2 + N2↑ + 6H2O。
,所以氧化产物应该是硝酸亚铁,则反应的化学方程式是5Fe +12HNO3=5Fe(NO3)2 + N2↑ + 6H2O。
②硝酸和铁反应的化学方程式可能是Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。由于反应中有1/4的硝酸被还原,所以根据铁是0.1mol可知,硝酸的最小值和最大值分别是 16.8g和
16.8g和 ,则n的取值范围是16.8 ≤ n ≤ 25.2。
,则n的取值范围是16.8 ≤ n ≤ 25.2。
③设锌的物质的量是2xmol,则硝酸是4xmol,生成硝酸锌是2xmol,所以没有被还原的硝酸是4xmol,则被还原的硝酸是5xmol-4xmol=xmol,根据电子的得失守恒可知,硝酸在反应中得到4个电子,即还原产物是N2O;另外如果没有被还原的硝酸并没有全部和锌离子结合生成硝酸锌,则也可能生成硝酸铵,此时反应的化学方程式就是4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O,因此正确的答案是N2O或NH4NO3。
点评:该题难度较大,侧重考查学生的能力和综合素质,对学生的计算能力提出了更高的要求。该题有利于培养学生严谨的逻辑思维能力、发散思维能力以及灵活应变能力,有利于提高学生的学习效率和应试能力以及分析问题、解决问题的能力,增强学生的学习自信心。
本题难度:一般
3、选择题 下列反应完成后有沉淀的是
[? ]
A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOH
B.Ba(OH)2溶液与KNO3溶液加足量H2SO4
C.AgNO3溶液与Na2CO3溶液加足量稀HNO3
D.Ca(OH)2溶液与FeCl3溶液加足量稀
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列叙述不正确的是
A.焰色反应是物理变化
B.在玻璃导管尖嘴处点燃氢气时,由于玻璃中有钠离子,所以火焰带有黄色
C.做焰色反应时铂丝应用稀硫酸洗净,并灼烧至无色
D.在钠和钠的化合物中,钠原子和钠离子的焰色均为黄色
参考答案:C
本题解析:
本题难度:一般
5、填空题 实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无
色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如下表。
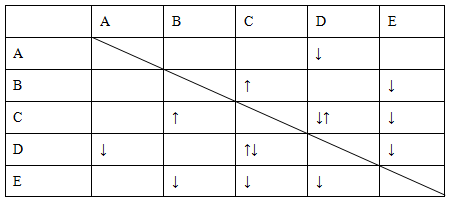
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:________。
(3)C、D两溶液反应的离子方程式为________。
(4)向含有0.1 mol溶液的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
参考答案:(1)NaHSO4 Ba(OH)2
(2)NH3·H2O NH4++OH-
NH4++OH-
(3)Al3++3HCO3—=Al(OH)3↓+3CO2↑
(4)0.25
本题解析:(1)C与D反应生成气体和沉淀,则C、D分别是NaHCO3、KAl(SO4)2中的一种;B与C反应只有气体生成,则B、C分别是NaHSO4、NaHCO3中的一种;据此可知C是NaHCO3,则D是KAl(SO4)2,B是NaHSO4;又由于E与B、C、D反应都有沉淀生成,故E是Ba(OH)2,A是NH3·H2O。(2)NH3·H2O是弱电解质,书写其电离方程式时要用可逆符号。(3)Al3+与HCO3—发生相互促进的水解反应。(4)当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,Al3+恰好完全沉淀,反应方程式为2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4;当KAl(SO4)2与Ba(OH)2按1∶2的物质的量之比混合时,SO42—完全沉淀,反应方程式为KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O。可见,当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,生成沉淀的物质的量最多。观察反应方程式可知0.1 mol KAl(SO4)2参与反应时生成0.25 mol沉淀。
本题难度:一般