1、选择题 关于盐类水解反应的说法正确的是
[? ]
A.溶液呈中性的盐一定是强酸强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱性的相对强弱
D.同浓度的NH4Cl和NaCl pH之和大于14
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列溶液中有关物质的量浓度关系正确的是( )
A.若pH=2的HA(aq)和pH=12的MOH(aq)混合溶液中存在c(H+)+c(M+)=c(OH-)+c(A-),则HA与MOH一定是等体积混合
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1mol?L-1的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
参考答案:A、若pH=2的HA(a?q)和pH=12的MOH(a?q)混合溶液,HA与MOH任意体积混合溶液中一定存在电荷守恒,c(H+)+c(M+)=c(OH-)+c(A-),故A错误;
B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液,碳酸钠水解程度大于醋酸钠,溶液浓度大小为:c(NaOH)<c(Na2CO3)<c(CH3COONa),故B错误;
C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合溶液中电荷守恒:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),物料守恒2c(Na+)=c(CH3COOH)+c(CH3COO-),合并计算得到:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),故C正确;
D、0.1mol?L-1的NaHA溶液,其pH=4,说明HA-水解程度小于电离程度,则c(HA-)>c(H+)>c(A2-)>c(H2A),故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 下列溶液中微粒的物质的量浓度关系不正确的是( )
A.将1molCl2全部溶入水形成的1L溶液中:2c(Cl2)+c(Cl-)+c(HClO)+c(ClO-)=2mol/L
B.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3)
C.物质的量浓度均为0.1mol/L的NaClO与NaHCO3组成的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.室温下,向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至呈中性:c(Na+)>c(SO42--)>c(NH4+)>c(OH-)=c(H+)
参考答案:B
本题解析:
本题难度:简单
4、选择题 有关①100ml?0.1?mol/L?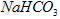 、②100ml?0.1?mol/L?
、②100ml?0.1?mol/L?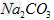 两种溶液的叙述不正确的是?
两种溶液的叙述不正确的是?
[? ]
A.溶液中水电离出的 个数:②>①?
个数:②>①?
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:?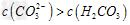 ?
?
D.②溶液中:?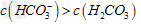
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.?用甘氨酸( )和丙氨酸(
)和丙氨酸(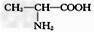 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
B.?0.1?mol/L?Na2S溶液中:c(OH-)=?c(H+)+?c(HS-)+?c(H2S)
C.?标准状况下,2.24L己烷含有分子的数目为0.1NA
D.?由离子方程式 +?XO3-?+?6H+?==?3X2?+?3H2O可判断X元素的最高化合价为+5价
+?XO3-?+?6H+?==?3X2?+?3H2O可判断X元素的最高化合价为+5价
参考答案:A
本题解析:
本题难度:一般