1、选择题 实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.10 mol·L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是(?)
A.NaCl
B.Ca(OH)2
C.Na2CO3
D.NaHCO3
参考答案:B
本题解析:此题考的是滴定中的计算问题,属于中等难度题型。
若没有杂质则n(样品)=2﹡10-3mol。 n(HCl)="C(HCl)*V(HCl)=0.10" mol·L-1 *0.019L=1.9﹡10-3mol>2﹡10-3mol,如果杂质不与盐酸反应则A正确,如果杂质能与盐酸反应,可用极值法计算,设样品全都是杂质计算求出1L溶液中杂质的质量。0.019mol盐酸中和Ca(OH)2?的质量为?0.7g ,则1L溶液含Ca(OH)2?3.5g。同理可求得Na2CO3 为5.035g,NaHCO3 为7.98g。只有当杂质的质量小于4.0g时才符合题意,因此不可能是B选项。
本题难度:简单
2、填空题 在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是?_______________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②?③(填“>”“=”或“<”)。
(3)在溶液④中,?离子的浓度为0.1mol/L;NH3·H2O和?离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-)?c(NH4+)(填“>”“=”或“<”)。
参考答案:(1) NH4++2H2O NH3·H2O+H+ (2) < (3) Cl- NH4+?(4)=
NH3·H2O+H+ (2) < (3) Cl- NH4+?(4)=
本题解析:(1)呈酸性的原因是铵根离子水解,NH4++2H2O NH3·H2O+H+
NH3·H2O+H+
(2)②0.1mol/L CH3COONH4?中醋酸根离子促进铵根离子水解,使铵根离子浓度最小,③0.1mol/L NH4HSO4?中氢离子抑制铵根离子水解;所以c(NH4+)的大小关系是②<③
(3)在溶液④中,Cl-离子的浓度为0.1mol/L, NH3·H2O和NH4+离子的浓度之和为0.2 mol/L
(4)溶液②中电荷守恒的式子为:[CH3COO-]+[OH-]=[H+] + [NH4+] 室温下pH=7则[OH-]=[H+],所以[CH3COO-]= [NH4+].
本题难度:一般
3、选择题 已知酸H2B在水溶液中存在下列关系:①H2B = H++HB—,②HB—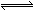 H++B2—,则下列说法中一定正确的是
H++B2—,则下列说法中一定正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性
C.NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB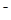 )+c(OH
)+c(OH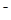 )+c(B
)+c(B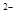 )
)
D.在Na2B溶液中一定有:c(OH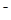 )=c(H
)=c(H )+c(HB
)+c(HB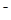 )
)
参考答案:AD
本题解析:
正确答案:AD
A.正确,NaHB不水解,溶液一定呈酸性,Na2B水解,溶液一定呈碱性
B.不正确;
C.不正确,NaHB水溶液中一定有:电荷守恒应为c(Na )+c(H
)+c(H )=c(HB
)=c(HB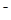 )+c(OH
)+c(OH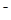 )+2c(B
)+2c(B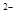 )
)
D.正确,在Na2B溶液中存在质子守恒,一定有:c(OH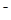 )=c(H
)=c(H )+c(HB
)+c(HB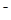 )
)
本题难度:一般
4、选择题 下列叙述正确的是(?)
A.浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,
则:c(CH3COO-)<c(CH3COOH)
B.浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-) + c(NH3·H2O)
C.浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合:c(Na+)+ c(H+)= c(CO32-)+ c(OH-) + c(HCO3-)
D.用pH=3的盐酸滴定10 mL pH=11的氨水,达到滴定终点用去盐酸的体积小于10 mL
参考答案:B
本题解析:浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,说明醋酸的电离大于水解,所以c(CH3COO-)>c(CH3COOH),故A错误;浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中,根据质子守恒,可以得到c(H+)=c(OH-) + c(NH3·H2O),故B正确;浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合得到浓度为0.05mol·L-1的碳酸钠溶液,在该溶液中,根据电荷守恒可以得到c(Na+)+ c(H+)= 2c(CO32-)+ c(OH-) + c(HCO3-),所以C错误;用pH=3的盐酸滴定10 mL pH=11的氨水,达到终点用去盐酸的体积大于10 mL,故D错误。
点评:本题考查了盐类水解,质子守恒,电荷守恒的知识,这些知识是高考考查的重点和难点,本题有一定的综合性,难度适中。
本题难度:简单
5、选择题 下列溶液中,各关系式正确的是()
A.等浓度、等体积的NaOH 和二元弱酸H2A 混和溶液中:
c(Na+) + c(H+) =c(HA-) + c(OH-) + c(A2-)
B.1 L 0.1 mol?L-1 CuSO4·(NH4)2SO4·6H2O 的溶液中:
c(SO42—) >c(NH4+)>c(Cu2+)>c(H+)>c(OH—)
C.已知两种弱酸HA、HB 的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol?L-1的HA、HB、NaA、NaB 溶液中:pH(NaA)>pH(NaB)>pH(HA)>pH(HB)
D.物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:
3c(H2CO3)+2c(H+)+c(HCO3—)=2c(OH—)+c(CO32—)
参考答案:BD
本题解析:
正确答案:BD
A.不正确,由电荷守恒,等浓度、等体积的NaOH 和二元弱酸H2A 混和溶液中:
c(Na+) + c(H+) =c(HA-) + c(OH-) + 2c(A2-)
B.正确,1 L 0.1 mol?L-1 CuSO4·(NH4)2SO4·6H2O 的溶液中:2mol?L-1c(SO42—)、NH4+要水解,c(NH4+)<2mol?L-1、Cu2+要水解,c(Cu2 +)<1mol?L-1,各离子浓度顺序为
c(SO42—) >c(NH4+)>c(Cu2+)>c(H+)>c(OH—)
C.不正确,已知两种弱酸HA、HB 的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol?L-1的HA、HB、NaA、NaB 溶液中:pH(NaB)>pH(NaA)>pH(HB)>pH(HA)
来源:91考试网 91Exam.orgD.正确,由电荷守恒和物料守恒的计算式,消去Na+的浓度,即可。物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:
电荷守恒
c(Na+) + c(H+) =c(HCO3―) + c(OH-) +2 c(CO32-)
物料守恒
2c(Na+)=3 c(HCO3―) + 3c(CO32-)+3c(H2CO3)
消去c(Na+)可得
3c(H2CO3)+2c(H+)+c(HCO3—)=2c(OH—)+c(CO32—)
本题难度:简单