1、填空题 25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① _________________________;?
② _________________________;?
③ _________________________。?
(2)溶液中共有 种不同的粒子(指分子和离子)。?
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。?
(4) 和 两种粒子物质的量之和等于0.01 mol。?
2、选择题 欲使0.1mol/L的KHCO3溶液[H+]、[CO32-]、[HCO3-]都减小,可采用的方法是( )
A.通入CO2气体
B.加入NaOH固体
C.通入HCl气体
D.加入饱和石灰水溶液
3、选择题 在K2Cr2O7溶液中存在如下平衡:Cr2O72- + H2O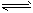 2CrO42- + 2H+。向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
2CrO42- + 2H+。向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
[? ]
A.加入X溶液,上述平衡正向移动
B.Cr2O72-的物质的量浓度增大
C.X溶液可能是NaOH溶液
D.再加入H2SO4,可使黄色溶液变为橙色
4、选择题 物质的量浓度相同的一元强碱和一元强酸相互反应时,溶液
A.呈酸性
B.呈碱性
C.呈中性
D.酸碱性无法判断
5、选择题 在20 mL1 mol/LNaHCO3溶液中,当HCO3-+H2O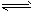 H3O++CO32-达到平衡后,要使c(CO32-)增大,可在溶液中加入少量的
H3O++CO32-达到平衡后,要使c(CO32-)增大,可在溶液中加入少量的
[? ]
A.H2O(l)
B.Ba(OH)2(s)
C.NaHSO3(s)
D.NaOH(s)