1、填空题 25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① _________________________;?
② _________________________;?
③ _________________________。?
(2)溶液中共有 种不同的粒子(指分子和离子)。?
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。?
(4) 和 两种粒子物质的量之和等于0.01 mol。?
参考答案:(1)①CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
②CH3COOH CH3COO-+H+
CH3COO-+H+
③H2O H++OH-
H++OH-
(2)7
(3)Na+ Cl-
(4)CH3COOH CH3COO-
本题解析:溶液中存在CH3COO-,则有水解平衡:CH3COO-+H2O CH3COOH+OH-;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOH
CH3COOH+OH-;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOH CH3COO-+H+;溶液中还存在水的电离平衡:H2O
CH3COO-+H+;溶液中还存在水的电离平衡:H2O H++OH-。溶液中存在的离子有:Cl-、Na+、CH3COO-、H+、OH-,分子有H2O、CH3COOH;能够水解的离子及电离(微弱)产生的离子随外界条件的变化浓度发生变化,故浓度为定值的是强酸、强碱对应的阴、阳离子,即c(Na+)="0.01" mol·L-1,c(Cl-)为0.002 mol·L-1。而由物料守恒c(CH3COO-)+c(CH3COOH)="0.01" mol·L-1,故CH3COO-和CH3COOH的物质的量之和为0.01 mol。
H++OH-。溶液中存在的离子有:Cl-、Na+、CH3COO-、H+、OH-,分子有H2O、CH3COOH;能够水解的离子及电离(微弱)产生的离子随外界条件的变化浓度发生变化,故浓度为定值的是强酸、强碱对应的阴、阳离子,即c(Na+)="0.01" mol·L-1,c(Cl-)为0.002 mol·L-1。而由物料守恒c(CH3COO-)+c(CH3COOH)="0.01" mol·L-1,故CH3COO-和CH3COOH的物质的量之和为0.01 mol。
本题难度:一般
2、选择题 欲使0.1mol/L的KHCO3溶液[H+]、[CO32-]、[HCO3-]都减小,可采用的方法是( )
A.通入CO2气体
B.加入NaOH固体
C.通入HCl气体
D.加入饱和石灰水溶液
参考答案:A、CO2+H2O=H2CO3,HCO3-?H++CO32-,所以二氧化碳溶于水后,氢离子和碳酸氢根离子浓度都增大,故A错误;
B、NaHCO3+NaOH=Na2CO3+H2O,所以加入氢氧化钠固体后,碳酸氢根离子浓度减小,碳酸根离子浓度增大,氢离子浓度减小,故B错误;
C、HCl+NaHCO3=NaCl+H2O+CO2↑,所以通入氯化氢气体后,碳酸氢根离子浓度减小,碳酸根离子浓度减小,碳酸氢钠溶液呈碱性,通入氯化氢后溶液碱性减弱,所以氢离子浓度增大,故C错误;
D、Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,所以加入饱和石灰水溶液后,碳酸氢根离子转化为碳酸钙沉淀,所以碳酸氢根离子浓度、碳酸根离子浓度都减小,溶液由弱碱性变为强碱性,所以氢离子浓度也减小,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 在K2Cr2O7溶液中存在如下平衡:Cr2O72- + H2O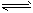 2CrO42- + 2H+。向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
2CrO42- + 2H+。向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
[? ]
A.加入X溶液,上述平衡正向移动
B.Cr2O72-的物质的量浓度增大
C.X溶液可能是NaOH溶液
D.再加入H2SO4,可使黄色溶液变为橙色
参考答案:B
本题解析:
本题难度:一般
4、选择题 物质的量浓度相同的一元强碱和一元强酸相互反应时,溶液
A.呈酸性
B.呈碱性
C.呈中性
D.酸碱性无法判断
参考答案:D
本题解析:略
本题难度:一般
5、选择题 在20 mL1 mol/LNaHCO3溶液中,当HCO3-+H2O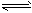 H3O++CO32-达到平衡后,要使c(CO32-)增大,可在溶液中加入少量的
H3O++CO32-达到平衡后,要使c(CO32-)增大,可在溶液中加入少量的
[? ]
A.H2O(l)
B.Ba(OH)2(s)
C.NaHSO3(s)
D.NaOH(s)
参考答案:BD
本题解析:
本题难度:一般