1、选择题 钨是我国的丰产元素之一。已知钨有多种天然稳定同位素,其相对原子质量为:183.84,有关叙述中正确的是(?)
A.183.84是1个钨原子质量与12C原子质量的1/12的比值
B.183.84是各种钨同位素的质量数和它们所占百分数得出的平均值
C.钨的同位素原子中的质子数和中子数约略相等
D.钨同位素原子的中子数远比其中的质子数要多
参考答案:D
本题解析:
【错解分析】短周期元素的原子核内原子数与中子数相等或约略相等,但H无中子。长周期元素的原子核里中子数均比质子数大得多,钨为长周期元素所以中子数比质子数明显的多。
【正解】相对原子质量对于有多种天然稳定的同位素的元素而言,不是“1个原子”与12C原子1/12的质量比值,因为只与一种同位素的质量相比,仅是“该同位素的相对原子质量”。错解的产生是因对相对原子质量的理解不透。B选项也不正确,一为“质量数”,一为“百分数”,后者未指明是原子百分数还是质量百分数。若为原子百分数。其求得的值只是“近似相对原子质量”。C,D选项的判断要归纳和观察原子序数的大小不同时,原子核内质子数与中子数的比例关系。
本题难度:简单
2、填空题 (12分)A、B、C、D、E、F均为元素周期表前20号主族元素,其核电荷数依次增大。其中A、B同周期,B、D同主族且相邻,A、B、D三种元素的核电荷数之和为30。C、E同周期,可形成1:1型的离子化合物。F的最外层电子数大于1。请回答:
(1)A、B、C、D、E、F六种元素的元素符号分别为_______________________?__;
(2)用化学式表示A、D、E最高价氧化物的水化物酸性由强到弱的顺序:_______;
(3)用化学式表示D、E氢化物的还原性由强到弱的顺序:_______;
(4)请写出C、E最高价氧化物对应水化物之间反应的化学方程式:________________。
参考答案:(共12分)(1)C、O、Na、S、Cl、Ca (各1分)(2)HClO4>H2SO4>H2CO3 ?(2分)(3)H2S> HCl(2分)?(4)HClO4 + NaOH ==NaClO4 + H2O(2分)
本题解析:B、D同主族且相邻,则B是第二周期,D是第三周期。C、E同周期,可形成1:1型的离子化合物,则该化合物应该是氯化钠或硫化镁。如果是硫化镁,则BD的原子序数之和就≤22,则A的原子序数最小是8,这和A的原子序数小于B的矛盾,所以C是钠,E是氯,则A是碳,B是氧元素,D是硫元素,F是钙。
(1)分别是C、O、Na、S、Cl、Ca。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是Cl>S>C,则酸性强弱顺序是HClO4>H2SO4>H2CO3。
(3)非金属性越强,相应氢化物的还原性越弱,所以还原性强弱顺序是H2S> HCl。
(4)C、E最高价氧化物对应水化物分别是强酸和强碱,方程式为HClO4 + NaOH ==NaClO4 + H2O。
本题难度:简单
3、选择题 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中
学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是
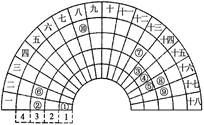
A.②、⑧、⑨对应简单离子半径依次减小
B.⑥的氯化物的熔点比⑦的氯化物熔点低
C.元素⑩处于常见周期表第四周期第VIIIB族
D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物
参考答案:D
本题解析:扇形元素周期表中1234代表周期,最外周的数字代表纵行,与常见元素周期表对照即得。A、②、⑧、⑨分别是Na、S、Cl其离子半径的大小顺序是S2->Cl->Na+,错误;B、⑥⑦分别是Mg、Al,MgCl2属于离子晶体,AlCl3属于分子晶体,前者的熔点高于后者,错误;C、元素⑩是铁元素,位于常见周期表第四周期第VIII族,错误;D、①、③、④、⑤分别是H、C、N、O元素,H与C形成的大部分烃、与N形成的N2H4、与O形成的H2O2中均既含极性键又含非极性键,正确,答案选D。
本题难度:一般
4、选择题 下列有关元素的叙述正确的是(?)
A.白磷、红磷都是磷元素的单质,它们之间的转化属于物理变化
B.地壳中元素含量最高的非金属是 硅、含量最高的金属是铝
硅、含量最高的金属是铝
C.原子最外层只有一个 电子的都是金属元素
电子的都是金属元素
D.元素周期表中,第三纵行元素种类最 多;第十四纵行元素形成的化合物种类最多
多;第十四纵行元素形成的化合物种类最多
参考答案:D
本题解析:略
本题难度:简单
5、填空题 (12分)主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
⑴A、B、C、D分别是? ?、? ?、 ?、? ?;(填元素符号)
⑵D的离子结构示意图为? ?,A与B形成的化合物的电子式为? ?;
⑶B、C的气态氢化物稳定性由强到弱的顺序为:??(写化学式,并用“<”或“>”表示强弱)。
(4)写出一种由A、B、C、D组成的化合物的化学式 。
参考答案:(第1小问每空1分、其余每空2分?共12分)
(1) H?、 O?、C?、Na?;(每空1分)
(2)钠离子结构示意图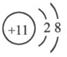 ;水的电子式
;水的电子式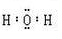
(3)CH4<H2O? (4)NaHCO3
本题解析:根据元素的结构及其性质可知,A、B、C、D分别是H、O、C、Na。
(2)钠离子是10电子微粒,结构示意图为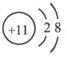 。水是含有极性键的共价化合物,电子式为
。水是含有极性键的共价化合物,电子式为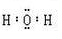 。
。
(3)非金属越强,相应氢化物的稳定性越强,氧元素的非金属强于碳元素的,所以甲烷的大小弱于水的。
(4)由A、B、C、D组成的化合物是碳酸氢钠,其化学式为NaHCO3。
本题难度:一般