1、选择题 下图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是(? )
A.Y的 氢化物比X的氢化物更稳定
B.原子半径大小顺序是Z>Y>X>R
C.Z的单质能与Y的某些化合物发生置换反应
D.X、Y、Z三种元素中,其最高价氧化物对应水化物的酸性强弱顺序是Z>Y>X
参考答案:B
本题解析:X原子最外层电子数比次外层电子数少3,则X是P,所以Y是S,R是O,Z是Cl。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐最大,所以选项B不正确,原子半径应该是X>Y>Z>R,其余都是正确的,答案选B。
本题难度:简单
2、选择题 短周期元素X、Y、Z在元素周期表中的位置下图所示,下列说法正确的是
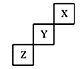
A.X、Y、Z三种元素中,单质在常温下均为气态
B.Z的氢化物的稳定性比Y的强
C.Y的最高正化合价为+5
D.Y的单质的熔点比Z的低
参考答案:D
本题解析:
试题分析;短周期指的是一二三周期,据图像及结合元素周期表可知X应为氦,Y应为氟,Z应硫故正确答案应为D选项
本题难度:一般
3、填空题 (15分).I下表是部分短周期元素的原子半径及主要化合价:
元素代号[
| W
| R
| X
| Y
| Z
| Q
| M
|
原子半径/nm
| 0.037
| 0.186
| 0.074
| 0.075
| 0.077
| 0.150
| 0.160
|
主要化合价
| +1
| +1
| -2
| -3、+5
| +2、+4
| +3
| +2
|
试用元素符号 、化学式回答下列问题:
、化学式回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是?。
M在Z的最高价氧化物中燃烧的化学方程式?。
(2)X可与R按1︰1的原子个数比形成化合物甲,甲中存在的化学键有?;
X可与W组成含18电子的化合物乙,则乙的电子式为?。
(3)上述元素组成的物质D、E在体积不变的密闭容器中发生可逆反应:2E(g)+D(g) 2G(g)根据下表中的数据判断下列图像错误的是?。
2G(g)根据下表中的数据判断下列图像错误的是?。

| p1(MPa)
| P2(MPa)
|
200
| 78.4
| 90.6
|
600
| 72.3
| 88.6
|
?
 II下图为有机物CH3OH新型燃料电池,其中CH3OH由?极(填a或b)通入,写出下列条件下负极电极反应方程式。
II下图为有机物CH3OH新型燃料电池,其中CH3OH由?极(填a或b)通入,写出下列条件下负极电极反应方程式。
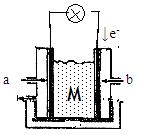
(1)若M为氢氧化钾溶液,?
(2)若M为熔融的碳酸钾??
(3)若M为传递O2-的固体电解质??
III一定量的浓硝酸与足量的铁铜合金反应,硝酸被还原
为NO 、 NO2 、 N2O4 ,其标准状况下的体积均为112mL ,若向所得溶液中加入0.1mol/L的氢氧化钠溶液?mL恰好能使溶液中的金属离子沉淀完全。
参考答案:(15分)I.第三周期IA族;(1分)? 2Mg+CO2="=2MgO+C?" (1分)
 (2)离子,共价键;(1分)? H∶O∶O∶H(1分)
(2)离子,共价键;(1分)? H∶O∶O∶H(1分)
(3)BD(2分)
II? a (1分)
(1)CH3OH –6e-?+8 OH- = CO32-+6H2O(2分)
(2) CH3OH –6e- +3 CO32- = 4CO2 +2H2O(2分)
(3) CH3OH –6e- +4O2- = CO32- +2H2O(2分)
III? 300mL(2分)
本题解析:略
本题难度:一般
4、选择题 下列说法不正确的是(?)
A.NCl3、PCl3、CO2、CCl4分子中各原子均达到8e-稳定结构
B.若R2-和M+的电子层结构相同,则原子序数:R>M
C.F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
D.原子序数为34号的元素属于长周期的主族元素
参考答案:B
本题解析:只要分子中元素化合价的绝对值和元素原子的最外层电子数之和满足8,则该原子就能达到8电子稳定结构,所以选项A中各原子均达到8e-稳定结构,A正确。若R2-和M+的电子层结构相同,则原子序数是R小于M,B不正确。卤素单质的熔点随原子序数的增大而增大,C正确。原子序数为34号的元素Se,位于周期表的第四周期第ⅥA,属于长周期主族元素,D正确,答案选B。
本题难度:简单
5、选择题 下列关于碱金属某些性质的排列中,正确的是
A.原子半径:Li<Na<K<Rb<Cs
B.密度:Li<Na<K<Rb<Cs
C.熔点、沸点:Li<Na<K<Rb<Cs
D.还原性:Li>Na>K>Rb>Cs
参考答案:A
本题解析:考查元素周期律的应用。碱金属元素自上而下原子半径逐渐增大,金属性逐渐增强,单质的密度和熔沸点都是逐渐减小的,所以选项A正确,B、C、D都是错误的。答案选A。
本题难度:一般