1、选择题 下列物质中,导电性能最差的是 (?)
A.熔融的氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
参考答案:D
本题解析:前三者都能导电,后者是不导电的,只有在水溶液和熔融状态才能导电。故选D。
点评:溶液导电能力强弱与离子浓度有关,与离子所带电荷数有关。浓度越大,电荷数越多,导电能力越强。和是不是强电解质没有必然联系。
本题难度:一般
2、选择题 0.1mol?L-1KHS溶液中(呈碱性),下列表达式不正确的是( )
A.c(K+)+c(H+)=c(OH-)+c(HS-)+2?c(S2-)
B.c(K+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
C.c(HS-)+c(S2-)+c(H2S)=0.1?mol?L-1
D.c(K+)>c(HS-)>c(OH-)>c(H2S)>c(H+)
参考答案:A.溶液遵循电中性原则,即c(K+)+c(H+)=c(OH-)+c(HS-)+2?c(S2-),故A正确;
B.溶液中存在水的电离,应存在c(H+)>c(S2-),故B错误;
C.0.1mol?L-1KHS溶液中含有:HS-、S2-、H2S,由物料守恒可知c(HS-)+c(S2-)+c(H2S)=0.1?mol?L-1,故C正确;
D.溶液中存在水的电离,并且HS-水解程度大于HS-电离程度,存在HS-?H++S2-,HS-+H2O?H2S+OH-,H2O?H++OH-,则c(OH-)>c(H2S)>c(H+),因水解程度较弱,则c(K+)>c(HS-)>c(OH-)>c(H2S)>c(H+),故D正确.
故选B.
本题解析:
本题难度:一般
3、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A = H+ + HA- HA- H+ + A2-
H+ + A2-
回答下列问题:
?(1)用离子方程式表示Na2A溶液显"酸性""或中性"或"碱性"的原因 __________________________________________
(2)在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A.c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B.c(OH-)=c(H+) +c( HA-)+2c(H2A)
C.c(Na+)+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D.c(Na+ ) >c(A2-)>c( HA-) >c(OH-) >c(H+)
(3)常温下,已知0.1mol·L-1NaHA溶液的pH=2,则当H2A溶液中c(H+)为0.11 mol·L-1时,H2A溶液的物质的量浓度应___________ 0.1mol/L(填">"或"<"或"="); 理由是_______________________________。
(4)比较①0.1mol·L-1 Na2A溶液 ②0.1mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①_________ ②(填">"或"<"或"=")。
参考答案:(1)A2- + H2O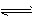 HA- + OH-
HA- + OH-
(2)ABC?
(3)> ;H2A-级电离出H+ ,对HA-电离起抑制作用,而NaHA中不存在抑制
(4)>
本题解析:
本题难度:困难
4、选择题 已知25℃时有关弱酸的电离平衡常数如下,则下列有关说法不正确的是
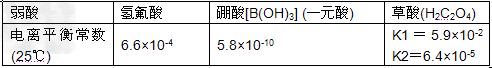
[? ]
A.硼酸为一元弱酸
B.amol·L-1?HF溶液与b?mol·L-1?NaOH溶液等体积混合后,所得溶液中c(Na+)>c(F-),则b一定大于a
C.同温下,NaHC2O4溶液中HC2O4-的电离常数大于K2(草酸的二级电离)
D.NaHC2O4和Na2C2O4混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列说法正确的是?
[? ]
A.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 ?
B.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 ?
C.不含金属元素的化合物也可能是离子化合物 ?
D.显酸性的溶液中的溶质只能是酸或强酸弱碱盐
参考答案:C
本题解析:
本题难度:简单