1、选择题 一定条件下反应2AB(g) A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是
A.单位时间内生成n mol A2,同时生成2n molAB
B.单位时间内生成n mol B2,同时生成2n molAB
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的物质的量分数不随时间变化
参考答案:C
本题解析:A、单位时间内生成n mol A2,同时生成2n molAB,说明正反应速率等于逆反应速率,可确定达到平衡状态;B、单位时间内生成n mol B2,同时生成2n molAB,说明正反应速率等于逆反应速率,可确定达到平衡状态;C、AB的消耗速率等于A2的消耗速率,不等于化学方程式的系数之比,正反应速率不等于逆反应速率,反应没有达到平衡状态;D、容器中各组分的物质的量分数不随时间变化,说明反应达到平衡状态。
本题难度:一般
2、选择题 一定条件下将2 mol SO2和2 mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量大于n mol的是(?)
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量大于n mol的是(?)
A.2 mol SO2+1 mol O2
B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+ 2 mol SO3
D.3 mol SO2+1 mol O2+1 mol SO3
参考答案:CD
本题解析:因为加入2 mol SO2、2 mol SO3和以下两种加入物质的情况是完全等同的:①4 mol SO2、1 mol O2;②3 mol SO2、0.5mol O2、1 mol SO3。所以按A加入物质达到平衡状态时SO3会小于n mol;按B加入物质达到平衡状态时SO3恰好为n mol;C可以看成是先加入2 mol SO2、2 mol SO3,待反应达到平衡状态后再加入1 mol O2,达到新平衡状态时SO3的物质的量大于n mol;D可以看成是先加入3 mol SO2、0.5 mol O2、1 mol SO3,反应达到平衡状态后再加入0.5 mol O2,达到新平衡状态时SO3的物质的量大于n mol。所以选C、D。
本题难度:简单
3、填空题 .(9分)在0.l mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH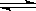 CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。
CH3COO-+H+,请根据该平衡完成下列表格,电离平衡移动方向填“正方向”或“逆方向”,离子浓度的变化请用“增大”、“减小”或“不变”表示。
改变条件
| 电离平衡移动方向
| c(H+)
| c(CH3COO-)
|
加水稀释
| ?
| ?
| ?
|
加少量冰醋酸
| ?
| ?
| ?
|
加入少量CH3COONa固体
| ?
| ?
| ?
参考答案:(9分)每空1分
改变条件
电离平衡移动方向
c(H+)
c(CH3COO-)
加水稀释
正方向
减小
减小
加少量冰醋酸
正方向
增大
增大
加入少量CH3COONa固体
逆方向
减小
增大
本题解析:弱电解质的电离平衡受温度、浓度、酸、碱及盐等的影响;
(1)加水稀释,平衡正向移动,促进电离,但c(H+)、c(CH3COO-)均减小,电解程度增大
(2)加入少量冰醋酸,增大反应物浓度,平衡正向移动,c(H+)、c(CH3COO-)均增大,但电解质电离程度减小
(3)加入少量CH3COONa固体,c(CH3COO-)增大,平衡左移,c(H+)减小
本题难度:一般
4、选择题 一定条件下,反应:6H2 + 2CO2 C2H5OH + 3H2O的数据如下图所示。 C2H5OH + 3H2O的数据如下图所示。
 ? ?
下列说法正确的是
A.该反应的△H > 0
B.达平衡时,v(H2)正 = v(CO2)逆
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90 %
参考答案:D
本题解析:A、温度升高,二氧化碳的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应,该反应的△H <0,错误;B、氢气与二氧化碳的物质的量比是3:1,所以达平衡时,v(H2)正 ="3" v(CO2)逆 ,错误;C、该反应是放热反应,所以升高温度平衡常数K值减小,b点温度高于c点,则b点对应的平衡常数K值小于c点,错误;D、氢气与二氧化碳的物质的量比是3:1,a点的二氧化碳的平衡转化率是60%,曲线I:n(H2):n(CO2)=2,则氢气的平衡转化率是60%×3/2=90%,正确,答案选D。
本题难度:一般
5、选择题 可逆反应A(g) + 3B(g)  2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是(?) 2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是(?)
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.平衡后再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+3Q2 kJ·mol-1 A(g)+3B(g);△H=+3Q2 kJ·mol-1
参考答案:D
本题解析:略
本题难度:一般
|