1、填空题 (6分)一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。

(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
A.v消耗(CH3OH)=" 2" v消耗(H2) B.CO、H2、CH3OH的浓度均不再变化
C.混合气体的平均相对分子质量不再改变 D.混合气体的密度不再改变
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小
参考答案:(1)2nB/3tB mol/(L
本题解析:
本题难度:一般
2、填空题 现有反应:CO(g)+H2O(g)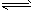 CO2(g)+H2(g),其△H<0,在850℃时,Kc=1。
CO2(g)+H2(g),其△H<0,在850℃时,Kc=1。
(1)若升高温度到950℃时,达到平衡时Kc______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容器可变的密闭容器中同时充入1.0molCO,3.0molH2O,1.0molCO2和xmolH2,则:
①当x=5.0时,上述平衡向__________(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是____________。
(3)在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%和b%,则a________b(填“大于”、“小于”或“等于”)。
参考答案:(1)小于
(2)①逆反应;② 0≤ x<3.0
(3)小于
本题解析:
本题难度:一般
3、选择题 下列说法中,正确的是( )
A.0.lmol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+)
B.等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少
C.将nmolH2(g)、nmolI2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
D.某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,若a>7时,则该溶液的pH一定为14-a
参考答案:A、0.lmol/L醋酸钙溶液中,Ca2+浓度为0.1mol/L,CH3COO-浓度为0.2mol/L,醋酸根离子水解使溶液呈碱性,但水解程度很小,所以离子浓度故选为c(CH3COO-)>c(Ca2+)>c(OH-)>c(H+),故A错误;
B、金属镁和溶液反应的实质是和氢离子之间的反应,等体积等pH的NH4Cl溶液、盐酸中氢离子浓度相同,开始时的速率相同,但金属镁对铵根离子的水解起促进作用,所以会使铵根的水解平衡向右移动,氢离子的量会增多,过程中反应速率大于盐酸,氯化铵反应用时少,故B正确;
C、将nmolH2(g)、nmolI2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,由于反应前后的气体体积不变,所以达到相同的平衡,转化率相同,故C错误;
D、某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,若a>7时,水的电离得到抑制,所以该物质是酸或碱,若是酸该溶液PH为14-a,弱为碱该溶液的pH为a,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 在一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)( )
A.单位时间生成NA的A2同时生成NA的AB
B.容器内的总压不随时间变化
C.单位时间生成2NA的AB同时生成NA的B2
D.单位时间生成NA的A2同时生成NA的B2
参考答案:A、单位时间生成NA的A2同时生成2NA的AB时反应达到平衡状态,所以单位时间生成NA的A2同时生成NA的AB时反应不达到平衡状态,故A错误;
B、通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,故B错误;
C、单位时间内生成2NA的AB同时生成NA的B2,说明正逆反应速率相等,达到平衡状态,故C正确;
D、无论是否达到平衡状态,都存在单位时间内生成NA的A2同时生成NA的B2,不能说明正逆反应速率相等,故D错误.
故选C.
本题解析:
本题难度:简单
5、填空题 (12分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)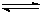
CH3OH(g)。图1表示反应进行过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂),图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。
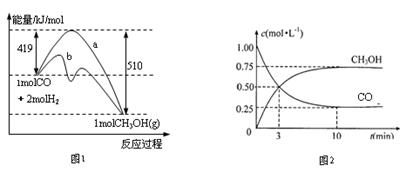
(1)下列说法正确的是______________
A.反应进行到3min时达到化学平衡状态
B.是否使用催化剂对反应前后的能量变化没有影响
C.当反应物消耗量一定时,若反应生成液态甲醇,能量变化值会更大
D.平衡时氢气的浓度为1mol/L