1、选择题 对于可逆反应:A(g)?+?2B(g)? 2C(g);△H>0,下列图像中正确的是?
2C(g);△H>0,下列图像中正确的是?
[? ]
A.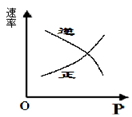
B.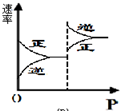
C.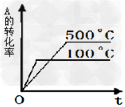
D.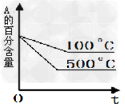
参考答案:D
本题解析:
本题难度:一般
2、填空题 氮及其化合物在工农业生产中具有重要作用。
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g)?△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)?△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
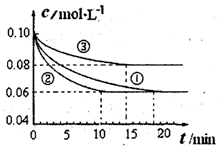
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为?。与实验①相比,.实验②所采用的实验条件可能为?(填字母),实验③所采用的实验条件可能为?(填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)?△H<0欲提高废气中氮氧化物的转化率,可采取的措施是?(填字母)
2N2(g)+3H2O(g)?△H<0欲提高废气中氮氧化物的转化率,可采取的措施是?(填字母)
a.升高温度? b.增大压强? c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到?(填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为?。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a?b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为?。
参考答案:(12分)(1)0.012mol/(L?min)(2分) e(1分) c(1分) (2)c(2分)
(3)HClO(1分) 67.5(2分) (4)>(1分) 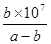 mol/L(2分)
mol/L(2分)
本题解析:(1)根据图像可知,实验②中反应进行到10min到达平衡状态,平衡时氮气的物质的量浓度减少了=0.1mol/L-0.06mol/L=0.04mol/L。根据方程式可知,氢气的浓度变化量△c(H2)=3△c(N2)=3×0.04mol/L=0.12mol/L,所以υ(H2)=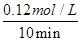 =0.012mol/(L?min);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
=0.012mol/(L?min);根据图像可知,与实验①相比,实验②到达平衡所用时间比较短,反应速率较快,但平衡时氮气的浓度不变,即改变条件平衡不移动。由于该反应正反应是气体体积减小的反应,故实验②的条件应是使用了催化剂,答案选e;根据图像可知,与实验①相比,实验③到达平衡所用时间也比较短,反应速率较快,但平衡时氮气的浓度增大,这说明改变体积平衡向逆反应移动。由于该反应正反应是体积减小的放热反应,因此实验③所采用的实验条件是升高温度,答案选c。
(2)提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,则:
a.该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
b.该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;c.增大NH3的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确,答案选c。
(3)NCl3遇水发生水解反应生成NH3,这说明NCl3分子中负价原子结合水电离的H+,因此正价原子结合水电离的OH-,所以生成NH3的同时还得到HClO;反应中只有氯元素的化合价发生变化,氯元 素由NCl3中+1降低为Cl-中-1价,得到电子;由ClO2-中+3价升高为ClO2中+4价,失去1个电子,即每生成1molClO2,反应中就转移1mol电子。所以当转移1mol电子时,生成ClO2的物质的量为1mol,质量为1mol×67.5g/mol=67.5g。
(4)溶液显中性,所以c(H+)=c(OH-)。根据溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+ c(OH-),因此c(NH4+)=c(Cl-)。氯化铵是强酸弱碱盐,NH4+水解,其水溶液呈酸性,因此要使氯化铵溶液呈中性,则氨水应稍微过量。因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,即a>b;溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=0.5bmol/L,所以c(NH3?H2O)=0.5amol/L-0.5bmol/L。电离常数只与温度有关,则此时NH3?H2O的电离常数Kb=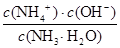 =
=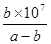 mol/L.。
mol/L.。
本题难度:一般
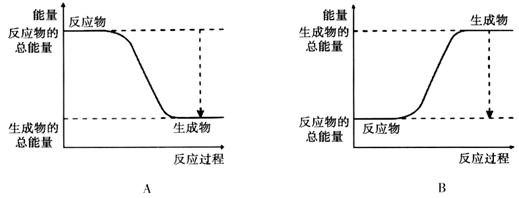
3、填空题 (12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键
| H—H
| O=O
| H—O
|
键能kJ/mol
| 436
| 496
| 463
|
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
参考答案:(1)A; 242 ; (2) Cu ;还原; 正; 0.2;
(3)0.2mol/(L.min) ; 2; 小于; 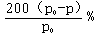 。
。
本题解析:(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,则反应物的能量高于生成物的能量,所以下图能正确表示该反应中能量变化的是A。则生成1mol水可以放出热量是2×463-436-496×1/2=242(KJ)。(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,由于在室温下Fe在浓硝酸中会发生钝化,所以活动性较弱的Cu作负极;若Zn、Ag和稀盐酸构成原电池,则活动性强的Zn作负极,Ag作正极,在正极上发生H+得到电子变为氢气,发生还原反应;根据同种电荷相互排斥,异种电荷相互吸引的原则,电解质溶液中阳离子移向负电荷较多的正极;质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中Zn作负极,被氧化,若一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。根据反应方程式Zn+Cu2+=Zn2++Cu,可知每消耗65g锌,在正极就产生64g的Cu,两个电极质量相差129g,转移电子2mol,现在二者质量差为12.9 g,所以导线中通过的电子的物质的量是0.2mol;(3)根据题意可知反应消耗A1.2mol,则同时会消耗B0.4mol,所以v(B)= 0.4mol÷2L÷1min=0.2mol/(L.min); v(C)= 0.4mol/L÷1min=0.4mol/(L.min); v(B):v(C)=1:2.所以x="2;" 若反应经2min达到平衡,因为反应是在体积固定的容器内进行,随着反应的进行,物质的浓度会减小,速率会减慢,所以前1minC变化浓度是0.4mol/L,后1min内C的浓度变化会小于0.4mol/L。因此若反应经2min达到平衡,平衡时C的浓度<0.8mol/L, 在体积固定的密闭容器内进行的化学反应,容器内气体的压强之比等于它们的物质的量的比。 3A(g)+B(g) 2C(g),
2C(g),
反应开始时气体的物质的量(mol) 3 1 0
反应消耗气体的物质的量(mol x x/3 2x/3
平衡时气体的物质的量(mol) 3-x 1-x/3 2x/3
[(3-x) +(1-x/3)+2x/3]÷(3+1)= p/p0;
解得x=6(p0-p)/ p0.
所以A的转化率是(x÷3)×100%={[6(p0-p)/ p0]÷3]} ×100%=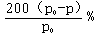 .
.
考点:考查原电池反应原理、反应热、方程式系数的确定、化学反应速率、物质的转化率的计算的知识。
本题难度:一般
4、选择题 2007年国家最高科学技术奖授予石油化工催化剂专家闵恩泽教授,以表彰他在催化剂研究方面做出的突出贡献。下列关于催化剂的说法中正确的是
[? ]
A.使用催化剂可以增大正反应速率,减小逆反应速率
B.使用催化剂可以提高反应物的转化率
C.使用催化剂可以降低反应的活化能
D.使用催化剂可以改变反应的平衡常数
参考答案:C
本题解析:
本题难度:一般
5、选择题 在高温下反应2HBr(g)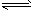 H2(g)+Br2(g),其△H>0,达平衡时,要使混合气体的颜色加深,可采取的方法是
H2(g)+Br2(g),其△H>0,达平衡时,要使混合气体的颜色加深,可采取的方法是
[? ]
A.减小压强
B.扩大体积
C.升高温度
D.增大氢气的浓度
参考答案:C
本题解析:
本题难度:一般