1、选择题 对于反应:C(S)+H2O(g)?

CO(g)+H2(g),△H>0,为了提高C(S)的转化率,可采取的措施是( )
A.升高反应温度
B.降低反应温度
C.增大体系的总压力
D.多加入C(S)
参考答案:A.升高温度,平衡向正反应分析移动,C(S)的转化率增大,故A正确;
B.降低温度,平衡向逆反应方向移动,C(S)的转化率减小,故B错误;
C.增大体系的总压力,平衡向逆反应方向移动,C(S)的转化率减小,故C错误;
D.多加入C(S),固体对平衡移动没有影响,C(S)的转化率不变,故D错误.
故选A.
本题解析:
本题难度:简单
2、填空题 已知反应:aA(g)+bB(g)?cC(g)
根据图形推测:
(1)P1______P2?(?填>或<)
(2)a+b______c?(?填>或<)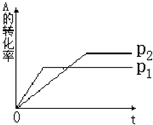
参考答案:(1)由图象可知P1曲线反应速率较大,说明P1压强较大,故答案为:>;
(2)压强增大,A的转化率减小,说明增大压强,平衡向逆反应方向移动,则有a+b<c,故答案为:<.
本题解析:
本题难度:一般
3、填空题 (11分)已知N2O4 (g)  ?2NO2 (g)?ΔH<0,
?2NO2 (g)?ΔH<0,
(1)现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。

(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”、“不变”或“减小” )。反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是?(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动。
参考答案:(2分)(1)a、d
(4分)(2)不变? 0.1mol·L-1·s-1
(5分)(3)NH4++H2O NH3·H2O+H+?逆向
NH3·H2O+H+?逆向
本题解析:(1)化学反应平衡的判断可从以下几方面考虑:体系中所有反应物和生成物的质量(或浓度)保持不变,正反应速率等于逆反应速率。对于N2O4 (g)  ?2NO2 (g),反应后体积变大,a密度不变,说明体积不变,故平衡;bΔH=E生-E反,ΔH不随时间的变化,但会随着化学计量数的变化而变化;c化学平衡应该是正逆反应速率相等,而图中表示的都是正反应速率;dN2O4的转化率不变,也说明了化学反应达到平衡。
?2NO2 (g),反应后体积变大,a密度不变,说明体积不变,故平衡;bΔH=E生-E反,ΔH不随时间的变化,但会随着化学计量数的变化而变化;c化学平衡应该是正逆反应速率相等,而图中表示的都是正反应速率;dN2O4的转化率不变,也说明了化学反应达到平衡。
(2)化学平衡常数只是温度的函数,故温度不变,平衡常数就不变。
N2O4 (g)  ?2NO2 (g)
?2NO2 (g)
n前?1?0
n反?0.3 ?0.6
n后?0.7? 0.6
V(N2O4)=0.3molL_1/3s=0.1molL_1/s
(3)NH4NO3是强酸弱碱盐,故水溶液铵根会水解,使溶液显酸性,方程式为NH4++H2O NH3·H2O+H+,氨水是弱碱,弱碱是抑制水的电离,故水的电离平衡将逆向进行。
NH3·H2O+H+,氨水是弱碱,弱碱是抑制水的电离,故水的电离平衡将逆向进行。
点评:此题考核了化学反应平衡的判断,也考核了化学平衡常数的知识和电离水解知识,要牢记盐类的水解促进水的电离,弱酸弱碱的电离抑制水的电离。
本题难度:一般
4、选择题
反应N2O4(g)?2NO2(g);△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.若P2>P1,则化学平衡常数KA>KC
参考答案:C
本题解析:
本题难度:简单
5、填空题 (12分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示 _________ ,K值大小与温度的关系是:温度升高,K值_____________ 。(填一定增大、一定减小、或可能增大也可能减小)。
(2) 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
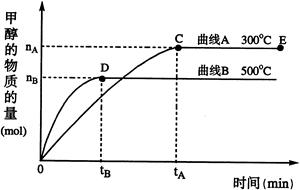
根据题意完成下列各题:
①反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
②在500 ℃,从反应开始到平衡,氢气的平均反应速率v (H2)= 。
③据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:_________________________(用化学方程式表示)。
参考答案:(12分)
(1) 可逆反应的进行程度越大 可能增大也可能减小
(2) ①K=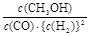 ; 减小。 ②
; 减小。 ② mol·(L·min)-1。
mol·(L·min)-1。
③Cu2O+CO 2Cu+CO2
2Cu+CO2
本题解析:本题考查了化学平衡移动的基本知识与技能。
(2)①由图像可知,升高温度,产物的量减小,即平衡左移,K值减小,正反应是放热反应。②v= =
=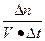 =
= mol·(L·min)-1
mol·(L·min)-1
本题难度:一般