1、实验题 (12分)碱式碳酸镁[一般以xMgCO3?yMg(OH)2?zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:
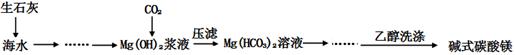
(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是:?。
②氢氧化镁浆液与CO2反应的化学方程式为:
?。
③碱式碳酸镁用乙醇洗涤的目的是:?。
(2)已知:碱式碳酸镁分解反应方程式为:
xMgCO3?yMg(OH)2?zH2O  (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g。根据实验测定的数据,确定碱式碳酸镁[xMgCO3·yMg(OH)2?zH2O]的化学式(要求写出计算过程)。
参考答案:(1)①作燃料、提供能量?(2分)
② Mg(OH)2+2CO2 = Mg(HCO3)2?(2分)
③除去表面杂质、减少固体的损耗?(2分)
(2)由题意得:
n(Mg2+)=20.0g/40g·mol-1=0.5mol?(1分)
n(CO2)=17.6g/44g·mol-1= 0.4mol?(1分)
据元素守恒得:
m(MgCO3)=0.4mol×84g·mol-1=33.6g(1分)
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g(1分)
n(H2O)=44.6g-33.6g-5.8g/18g·mol-1=0.4mol(1分)
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3·Mg(OH)2·4H2O(1分)(其它过程合理也给分)
本题解析:(1)①CaCO3高温分解生成CaO和CO2,所以焦炭的作用是:作燃料、提供能量。
②根据流程图,CO2与Mg(OH)2反应后的产物经压滤得到Mg(HCO3)2,所以CO2与Mg(OH)2反应的化学方程式为:Mg(OH)2+2CO2 = Mg(HCO3)2
③因为碱式碳酸镁在水中引起轻微的碱性反应,不溶于乙醇,所以用乙醇洗涤可以除去表面杂质、减少固体的损耗。
(2)残留固体为CaO,碱石灰吸收CO2,质量增加量为CO2的质量,可得:
n(Mg2+)=20.0g/40g·mol-1=0.5mol?(1分)
n(CO2)=17.6g/44g·mol-1= 0.4mol?(1分)
据元素守恒得:
m(MgCO3)=0.4mol×84g·mol-1=33.6g(1分)
m[Mg(OH)2]=(0.5mol-0.4mol)=5.8g(1分)
n(H2O)=44.6g-33.6g-5.8g/18g·mol-1=0.4mol(1分)
x:y:z=4:1:4
则碱式碳酸镁的化学式为:4MgCO3·Mg(OH)2·4H2O(1分)
本题难度:一般
2、实验题 将无水乙醇逐滴滴入到红热的CuO中,生成的气体通过某白色粉末(装置外边用冰水冷凝)。 实验结果表明:
(I)白色粉末变蓝,并在上边凝有沸点为21℃的无色液体X。
(Ⅱ)X不能与溴水发生加成反应。
(Ⅲ)X能进行卤代反应,一分子X中最多只能有三个H原子被取代,实验测得4. 6g无水乙醇全部反应后, CuO失重1.6g。
(1)根据上述实验数据,可算出每个乙醇脱去的H原子数,从而得出液体X的化学式为__________ 。
(2)根据有机物分子结构理论,把乙醇分子在上述反应中的三种可能脱氢方式(在乙醇的结构式中用 表示脱去的氢原子)和脱氢生成物的结构式填入下表空格中。
表示脱去的氢原子)和脱氢生成物的结构式填入下表空格中。

(3)在上述三个产物中只有--式是液体X的结构式,请简述另外两式均不合理的原因。 ________________。
参考答案:(1)CH3CHO
(2)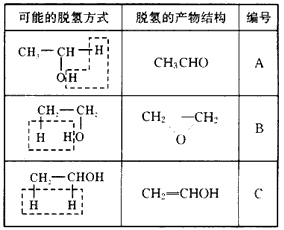
(3)A 因为B式有4个等同的氢,而C式中有C=C与X具有的性质Ⅱ不符
本题解析:
本题难度:一般
3、实验题 某学生模拟“李比希元素定量分析法”测定一种有机物X的组成,做了如下图所示的实验。他将0.3gX的蒸气由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果

①实验前B管的总质量(含CuO)为21.32g,实验后为21.00g。
②C管中收集到的物质电解后得到H2和O2,在D中收集到的是一种无色无味的气体。
③X的蒸气在标况下的密度为1.34g/L,问:
(1)该有机物X的化学式为____________________;
(2)实验中B装置中看到的现象是_________________________________;写出B装置中发生的化学方程式________________________________
参考答案:(1)CH2O
(2)黑色固体变成红色;CH2O+2CuO 2Cu+CO2+H2O
2Cu+CO2+H2O
本题解析:
本题难度:一般
4、填空题 实验室中有6瓶失去标签的白色固体:纯碱、氢氧化镁、氯化钡、硫酸铝、硫酸氢钠、氯化钾。除蒸馏水和试管、胶头滴管外,无其它任何试剂和仪器。某学生通过以下实验步骤即可鉴别它们。请填写下列空白:
⑴各取适量固体于6支试管中,分别加入适量蒸馏水,观察到的现象以及被检出的一种物质是: __________________________________________________;
⑵分别将所剩5种溶液依次编号为A、B、C、D、E,然后进行两两混合。观察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出。据此 可推断出:
可推断出:
①A、C、D三物质的化学式依次是_________________________________________;
②B、E两者中有一种可与A反应,它与足量A反应的离子方程式为:__________;
③在两两混合时,能确定BE成份的实验现象及结论是:____________________;
⑶上述物质溶于水抑制水的电离,且溶液显酸性的物质的化学式及其溶液显酸性的原因是__________________________________________________________。
参考答案:⑴有一支试管中的物质不溶于水,该种物质是Mg(OH)2;
⑵①NaHSO4、KCl、BaCl2;
②CO32-+2H+=H2O+CO2↑
③在B、E两溶液中,与A混合时产生气体的是纯碱,否则是硫酸铝。
⑶NaHSO4;原因是:NaHSO4=Na++H++SO42-,所产生的抑制水的电离。
本题解析:略
本题难度:一般
5、实验题 (14分)Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用右图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)
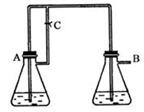
(1)则锥形瓶A中应加入的药品为_________________.(2分)
(2)锥形瓶B中应加入的药品为__________________.(2分)
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
①_____________________?②_______________________________。(4分)
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:?
?;(2分)
请写出此时B瓶中发生的化学反应的离子方程式:?
?;(4分)
参考答案:(1)铁和稀硫酸;(2分)?(2)氢氧化钠溶液。(2分)
(3)?①打开弹簧夹C;(2分)②反应一段时间后关闭弹簧夹C;(2分);
(4)A中液体被压入到B瓶,(1分);B瓶内生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色;(1分)
Fe2++2OH--=Fe(OH)2(2分);4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
本题解析:略
本题难度:简单