1、填空题 (14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。已知:
化学键
| N≡N
| H—O
| N—H
| O=O
|
键能/kJ·mol-1
| 945
| 463
| 391
| 498
|
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃
| 30
| 40
| 50
|
生成NH3量/(10-6mo1/L)
| 4.8
| 5.9
| 6.0
|
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为? ▲?;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条)? ▲?、? ▲?;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:
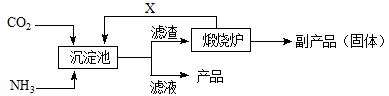
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
? ▲?。
②煅烧炉中产生的固态副产品为? ▲?,生产流程中能被循环利用的物质X为? ▲?。
参考答案:(14分)
(1)N2(g) + 3H2O( g) 2NH3(g) +
2NH3(g) + 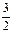 O2(g);△H =" +" 630 kJ·mol-1?(3分)
O2(g);△H =" +" 630 kJ·mol-1?(3分)
(2)①2.5×l0-8 mol/(L·min)或①1.5×l0-6 mol/(L·h)?(2分)
②升高温度;增大压强;?(合理均可,2分)
(3)①氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4?(3分)
②CaO(或生石灰)? CO2(或二氧化碳)?(各2分,共4分)
本题解析:略
本题难度:一般
2、计算题 氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%HNO3。两种产品的质量比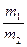 =x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
=x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
(1)导出理论所需水量(y)与质量比(x)的关系式(假定NH3的转化率为100%);
(2)求出只生产50%的HNO3所需水的量和只生产90%HNO3所需水的量;
(3)质量比(x)为多少时,进出水的量保持平衡,此时两种产品的总质量为多少?
参考答案:(1)
(2)脱去水11t
(3)81t
本题解析:本题联系化学工业生产实际,要求学生根据题目提供的条件进行有关硝酸工业上需水量的计算。化学试题与社会生产、生活、科技等的紧密结合与联系,对于学生在化学学习中坚持理论联系实际,学以致用,特别是摆脱封闭式的应试教育的藩蓠,实施开放式、多种形式的素质教育,充分拓宽自己的视野,提倡自主学习、自我研讨与探索,在自我获取知识的过程中提高自学能力和思维能力,有着十分重要的作用。(1)氨氧化法制硝酸的总的化学方程式为:NH3+2O2=HNO3+H2O,由此式可知:17t NH3可生成HNO363t、H2O 18t。根据题意,由HNO3量可建立等式:m1×50%+m2×90%=63……①
由H2O量可建立等式:y= m1×50%+m2×10%—18……②
联立①②结合m1/m2=x,即可得: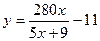 。
。
(2)解法1:只生成50%的HNO3时,50%的HNO3中含水为63t,因反应生成水为18t,所以需水为63-18=45t;只生成90%的HNO3时,90%的HNO3中含水为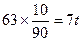 ,而反应生成水为18t,显然需脱去水18-7=11t。
,而反应生成水为18t,显然需脱去水18-7=11t。
解法2:根据 。只生成50%的HNO3时,m1/m2=x中x可视为非常大,则
。只生成50%的HNO3时,m1/m2=x中x可视为非常大,则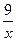 可视为0,
可视为0,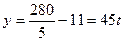 ;只生成90%的HNO3时,m1/m2=x中x为0,则
;只生成90%的HNO3时,m1/m2=x中x为0,则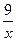 可视为无穷大,
可视为无穷大,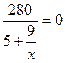 ,y=-11t,即需脱去11t水。
,y=-11t,即需脱去11t水。
(3)进出水平衡时,y=0。可得: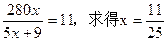 。设两种产品的总质量为w,则有:
。设两种产品的总质量为w,则有: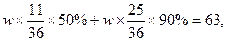 求得w=81t。
求得w=81t。
本题难度:简单
3、选择题 化学与科学、技术、社会、环境密切相关,下列说法中正确的是
[? ]
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
C.泄露在美国墨西哥湾海洋中的大量原油能被海洋生物迅速分解,不会导致生态灾难?
D.电镀废液中含浓度较高的含氮化合物,经中和后可直接用于浇灌农作物
参考答案:B
本题解析:
本题难度:简单
4、填空题 (12分)硫酸铜、硝酸铁都是重要的化工原料。
(1)以下是某工厂用含铁的废铜为原料生产胆巩(CuSO4·5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(∥100g水)见下表。
温度(℃)
| 20
| 40
| 60
| 80
| 100
|
石膏
| 0.32
| 0.26
| 0.15
| 0.11
| 0.07
|
胆矾
| 32
| 44.6
| 61.8
| 83.8
| 1 14 14
|
请回答下列问题:
①红褐色滤渣的主要成分是
②写出浸出过程中生成硫酸铜的化学方程式?;
③操作I的温度应该控制在?左右;
④从溶液中分离出硫酸铜晶体的操作Ⅱ应为:将热溶液?、?、洗涤、干燥。
(2)某兴趣小组在实验室用铁粉和稀硝酸及右图装置制取Fe(NO3)3(固定所用
仪器和加热装置未画出)。

①为保证原料的充分利用,并加快反应速率,往往将加热温度控制在100℃以内。该实验中对圆底烧瓶加热的最佳方式是?加热;
②请在图中虚线框内画出尾气吸收装置(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
参考答案:
(1)①Fe(OH)3? …………2分
②3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O …………2分
③100°C?…………2分
④冷却结晶、过滤? …………2分
(2)①水浴? …………2分
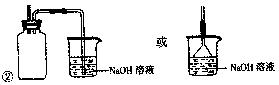 (其他合理答案也得分)
(其他合理答案也得分)
…………2分
本题解析:略
本题难度:一般
5、实验题 (8分,每空2分)工业上制取CuCl2的生产流程如下:
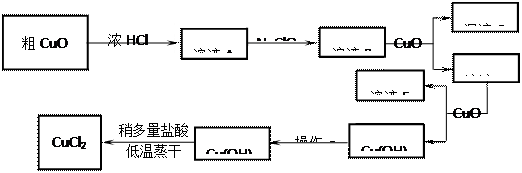 ?
?
请结合下表数据,回答下列问题:
物?质
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
|
溶度积/25℃
| 8.0×10-16
| 2.2×10-20
| 4.0×10-38
|
完全沉淀时的pH范围
| ≥9.6
| ≥6.4
| 3~4
|
⑴溶液A中加入NaClO的目的是?;
⑵在溶液B中加入CuO的作用是?;
⑶操作a的目的是?;
⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是?。
参考答案:⑴?将Fe2+氧化为Fe3+而使分离更加完全
⑵调节溶液的pH为3~4,使F e3+完全转变为F
e3+完全转变为F e(OH)3沉淀而分离Fe3+
e(OH)3沉淀而分离Fe3+
⑶洗涤Cu(OH)2表面的可溶性杂质
⑷抑制Cu2+的水解
本题解析:略
本题难度:一般