1、选择题 实验室为除去苯中含有的少量苯酚,通常采用的方法是
A.加氢氧化钠溶液,用分液漏斗分离
B.加乙醇,用分液漏斗分离
C.加热蒸馏,用分馏法分离
D.加浓溴水,用过滤法分离
参考答案:A
本题解析:分析:苯和苯酚互溶,混合物中加入NaOH溶液,生成苯酚钠,溶于水,但苯不溶于水,可用分液的方法分离,苯是一种良好的有机溶剂,溴、苯酚以及三溴苯酚都能溶于苯中.
解答:A.加氢氧化钠溶液,苯酚和氢氧化钠反应生成溶于水的苯酚钠,但苯不溶于水,可用分液的方法分离,故A正确;
B.苯、苯酚以及乙醇混溶,加入乙醇不能将二者分离,故B错误;
C.由于苯中含有少量的苯酚,加热蒸馏不能完全将二者分离,效果不好,故C错误;
D.加浓溴水,生成三溴苯酚,三溴苯酚和溴都能与苯互溶,不能将二者分离,并引入新的杂质,故D错误.
故选A.
点评:本题考查物质的分离、提纯方法,题目难度不大,注意把握相关物质的性质,为解答该题题目的关键之处,学习中注意把握相关知识的积累.
本题难度:困难
2、选择题 下列试剂中,能把NaOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是
A.NaCl
B.稀盐酸
C.NaNO3溶液
D.Na2CO3溶液
参考答案:D
本题解析:
正确答案:D
D. Na2CO3溶液与NaOH溶液、稀硫酸、CaCl2溶液作用的现象分别是:无明显现象、有气泡、有白色沉淀。A、B、C三选项均无明显现象,无法将三种溶液一次鉴别出来。
本题难度:简单
3、实验题 某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案:
 ?
?
?
⑴操作①的目的是?。
⑵操作②是否可改为加硝酸钡溶液?为什么?
⑶进行操作②后,如何判断SO42-已除尽,方法是?。
⑷操作③的目的是?,为什么不先过滤后加碳酸钠溶液?理由是?。
⑸操作④的目的是?
参考答案:除去NH4HCO3,NH4HCO3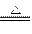 NH3↑+CO2↑+H2O;否,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,后面操作中无法除去;取上层清液加入BaCl2溶液,若无沉淀说明SO42-除尽;除去过量的Ba2+,减少一次过滤操作;除去溶解在溶液中的CO2及HCl;
NH3↑+CO2↑+H2O;否,改用Ba(NO3)2会使溶液中引入新的杂质离子NO3-,后面操作中无法除去;取上层清液加入BaCl2溶液,若无沉淀说明SO42-除尽;除去过量的Ba2+,减少一次过滤操作;除去溶解在溶液中的CO2及HCl;
本题解析:本题能力层次为D。NH4HCO3受热分解,用加热方法可以除去;用BaCl2除Na2SO4,稍过量的Ba2+用Na2CO3除去,然后再用盐酸除去稍过量CO32-。
进行实验方案设计时,首先要了解该实验的目标是什么;其次要清楚每一个实验步骤的目的是什么,理解它的化学原理,知道需要哪些化学仪器和药品,它们的作用是什么,如何使用;还要考虑加入试剂的先后顺序、试剂的用量,以及试剂过量后如何处理;以及实验操作应该注意什么问题,操作步骤是否能够简化等。
本题难度:简单
4、填空题 (1)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难______而易______.有机化工厂附近严禁火种,这是因为绝大多数有机物______.
(2)为了检验和除去下表中的各种物质中的杂质(括号里的物质),请从( I)中选出适当的检验试剂,从( II)中选出适当的除杂试剂,将所选的答案填入相应的空格内.
( I)检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶液C.盐酸D.氢氧化钠溶液
( II)除杂试剂:a.硫酸?b.酸性高锰酸钾溶液?c.新制的生石灰d.溴水
| 物质 | 检验试剂 | 除杂试剂
甲烷(乙烯)
酒精(水)
参考答案:(1)大多数有机物难溶于水,易溶于有机溶剂,动、植物油属于油脂,不溶于水,溶于有机溶剂,故用水洗不掉,但可用汽油洗去,大多数有机物易燃烧,有机化工厂附近严禁火种,
故答案为:溶于水;溶于有机溶剂;易燃烧;
(2)乙烯能使酸性高锰酸钾溶于褪色,甲烷不可以,可以检验乙烯存在;甲烷不能与溴水反应,乙烯可以与溴水发生加成反应,可以利用溴水除去甲烷中的乙烯;
无水硫酸铜吸水变蓝色,据此检验水的存在,用新制的生石灰吸水蒸馏除去酒精中的水,
故答案为:物质检验试剂除杂试剂甲烷(乙烯)酸性高锰酸钾溶液溴水酒精(水)无水硫酸铜新制的生石灰.
本题解析:
本题难度:简单
5、推断题 (4分)某固体混合物可能由K2SO4、NaCl、CuCl2和Na2SO3中的一种或几种组成.依次进行下列五步实验,观察到的现象记录如下:
①取一定量混合物加水溶解得无色透明溶液;
②向上述溶液中滴加足量BaCl2溶液,有白色沉淀生成,将该沉淀洗涤过滤干燥称得质量为a克;
③上述白色沉淀加入稀硝酸充分搅拌后,再次将沉淀洗涤过滤干燥称量,沉淀质量增加;
④往②的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.根据以上实验现象,可以判断出混合物中肯定含有的物质是?;肯定不含有的物质是?;不能判断混合物中是否含有的物质是?.
参考答案:Na2SO3?(1分)? ;? CuCl2 (1分) ;? K2SO4、NaCl (各1分)
本题解析:①向混合物中加入适量水全部溶解,溶液无色透明,说明一定不会含有不溶物或反应生成不溶物,所以可知该物质中一定不存在氯化铜;
②向步骤①溶液中滴加过量BaCl2溶液生成白色沉淀,则说明该白色沉淀可能是亚硫酸钡或硫酸钡,所以该物质中可能含有硫酸钾和亚硫酸钠;
③取步骤②的白色沉淀,加入稀硝酸沉淀质量增加,说明该沉淀一定有亚硫酸钡,故原物质中一定含有亚硫酸钠,不能确定是否有硫酸钡,从而可知该物质中不一定含有硫酸钾,。
④滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸,说明该白色沉淀一定是氯化银,但无法证明该溶液中的氯离子,是来自于原混合物还是②中加入的氯化钡所致,所以氯化钠无法确定。
综上可得混合物中肯定含有亚硫酸钠,一定不含有CuCl2,可能含有NaCl 、K2SO4。
点评:在解此类题时,首先分析题中的现象物质之间的关系,然后根据现象推出可以确定存在或不存在的物质,对于现象不能确定的只能再设计实验进行验证。
本题难度:一般
|