1、填空题 (8分)微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石、矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用:?
(2)从硫酸铜溶液中提取铜,简便而经济的方法是?;相应的化学方程式为:?
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。??
参考答案:(1)催化作用(2)向硫酸铜溶液中加入废铁,将铜置换出来;Fe+CuSO4=FeSO4+Cu
(3)普通方法煅烧硫化铜,产生烟尘和SO2气体污染环境。生物工程更有优点,它的优点是成本低、效益好,环境污染程度小
本题解析:略
本题难度:一般
2、填空题 (12分)A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如下所示转化关系。
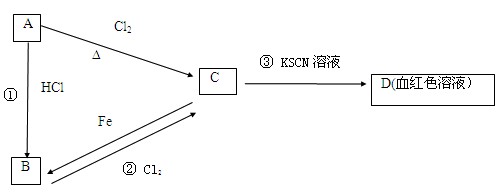
试回答下列问题:
(1)A是?,C是?。
(2)C的溶液与NaOH溶液混合后的现象是??。
(3)反应①的反应类型是?反应(选填“化合”“分解”“置换”“复分解”)。
参考答案:(12分)
(1)A是? Fe?,C是? FeCl3?。
(2)?产生红褐色沉淀?。
(3)?置换?。
本题解析:略
本题难度:一般
3、填空题 (18分)铁及其他合物在工业生产中有着广泛的应用。请按要求回答下列问题:
I.工业上利用硫酸铁矿烧渣(主要成分为Fe2O3、Al2O3、SiO2等)为原料提取Fe2O3,工艺流程如下图1:
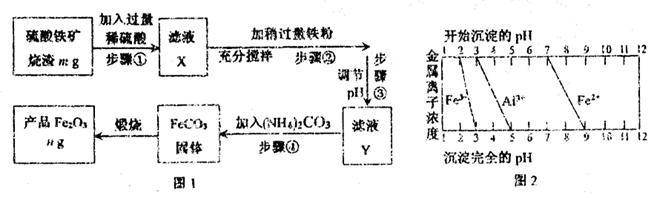
(1)滤液X中所含金属阳离子有?。
(2)步骤②中理论上发生反应的离子方程式依次为?。
(3)结合图2,分析步骤③调节pH的目的是 ?。
(4)假设流程中矿渣中的铁元素100%转化到产品中,则硫酸铁矿烧渣样品中Fe2O3的质量分数范围为(含m、n的代数式) ?。
(5)请设计实验室中以硫酸铁矿烧渣为原料提取氧化铁的另一种方案:向硫酸铁矿烧渣原料中加入过量稀硫酸、充分搅拌、过滤,再向滤液中加入足量的?溶液,接下来的一系列操作是搅拌、?、洗涤、?,最后获得纯净的产品Fe2O3。
Ⅱ.几位同学用铁盐溶液清洗试管中银镜,实验设想如下:
(6)甲:认为含Fe3+的盐无法洗去银镜。依据是Fe3+的氧化性(填“强于”或“弱于”)?Ag+的氧化性,所以反应Fe3++Ag→Fe2++Ag+不可以发生。
(7)乙:查资料发现,用FeCl3溶液可以清洗银镜,于是他亲自动手实验,发现银镜迅速消失,另外还观察到溶液变为浅绿色;为验证Fe3+的还原产物,可选择的试剂为 ?。结合甲的分析和自己的实验现象他得出结论:反应Fe2++Ag→Fe3++Ag是(填“可逆”或“不可逆”) ?反应。
(8)丙:结合甲、乙的设想,他用Fe(NO3)3溶液做对比实验,发现清洗银镜的速率慢许多,他重新观察乙的实验试管中有白色沉淀,于是结合化学平衡理论分析,得出用FeCl3溶液清洗银镜的离子方程式:??。
参考答案:(1)Fe3+、Al3+?(2)2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑ (3)沉淀铝离子
(4)小于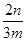 ?×100%?(5)氢氧化钠;过滤;灼烧?(6)弱于
?×100%?(5)氢氧化钠;过滤;灼烧?(6)弱于
(7)铁氰化钾溶液;可逆?(8)Fe3++Ag+Cl-=Fe2++AgCl
本题解析:(1)Fe2O3、Al2O3均能与稀硫酸反应生成硫酸铝、硫酸铁和水,SiO2与稀硫酸不反应,因此过滤后滤液X中主要含有铁离子和铝离子。
(2)滤液中含有过量的稀硫酸以及生成硫酸铁,二者均能与铁反应,反应的离子方程式为2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑。
(3)根据图2可知,随着溶液pH的升高,铝离子首先生成氢氧化铝沉淀,而溶液中的亚铁离子在留在溶液中,因此调节pH的目的是沉淀铝离子。
(4)根据流程图可知,在滤液X中加入铁粉时生成亚铁离子引入了铁元素。所以最终生成的氧化铁质量大于原矿石中氧化铁的质量。如果加入的铁粉恰好只与铁离子反应,则n值最小,此时得出的矿石中氧化铁的含量最高。设原矿石中氧化铁的物质的量是amol,则滤液X中铁离子的物质的量是2amol,根据方程式2Fe3++Fe=3Fe2+可知生成亚铁离子的物质的量是3amol,因此最终生成的氧化铁的物质的量是1.5amol,即160×1.5amol=n,解得a=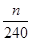 ,所以原矿石中氧化铁的含量为
,所以原矿石中氧化铁的含量为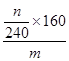 ?×100%=
?×100%=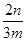 ×100%,因此样品中Fe2O3的质量分数范围为小于
×100%,因此样品中Fe2O3的质量分数范围为小于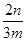 ×100%。
×100%。
(5)由于氢氧化铝是两性氢氧化物,因此要从滤液X中获得氧化铁,则可以加入过量的氢氧化钠溶液,过滤后得到氢氧化铁,洗涤后灼烧即可。
(6)根据金属活动顺序表可知,铁离子的氧化性弱于银离子的氧化性。
(7)铁离子的还原产物是亚铁离子,因此为验证Fe3+的还原产物,可选择的试剂为)铁氰化钾溶液;由于铁离子的氧化性弱于银离子的氧化性,而反应Fe2++Ag→Fe3++Ag可以发生,这说明反应应该是可逆反应。
(8)根据以上分析可知,硝酸铁溶液与银镜反应很慢,与氯化铁溶液反应快,这说明由于在反应中生成的银离子与氯离子结合生成了难溶性物质氯化银,从而促使平衡向正反应方向移动,反应的方程式为Fe3++Ag+Cl-=Fe2++AgCl。
本题难度:困难
4、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为

A.2∶1∶4
B.1∶2∶ 91exam.org4
C.1∶2∶1
D.1∶1∶4
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列化合物中,不能由化合反应制得的是( )
A.Fe(OH)3
B.FeCl2
C.Fe(OH)2
D.FeCl3
参考答案:C
本题解析:
本题难度:一般