1、选择题 将铜丝灼烧变黑后立即插入下列物质中,铜丝变红,且质量不变的是
A. HNO3
B.饱和澄清石灰水
C.C2H5OH
D. H2SO4
参考答案:.C
本题解析:在反应过程中,铜丝做催化剂。
本题难度:简单
2、实验题 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是Cu2O;
假设3:?。
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。?
(1)若假设1成立,则实验现象是?。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法是否合理,简述你的理由:?
?。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是?,写出发生反应的离子方程式?。
参考答案:(12分)Fe2O3和Cu2O?(1分)(1) 固体完全溶解,溶液呈血红色?(1分)
(2) 不合理?当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+可能完全与Cu反应生成Fe2+,滴加KSCN溶液后也可以不变红色。 (2分)
(3)? Fe2O3和Cu2O? Fe2O3+6H+=2Fe3++3H2O?Cu2O+2H+ =Cu+Cu2++H2O?2Fe3++Cu=2Fe2++Cu2+ ?(各2分)
本题解析:根据假设1和假设2可知,假设3应该是红色粉末是Fe2O3和Cu2O。
(1)若假设1成立,则溶液中含有Fe3+,Fe3+遇到KSCN溶液呈红色,即实验现象是固体完全溶解,溶液呈血红色。
(2)如果混合物中含有Cu2O,遇到酸产生Cu,Cu可能与Fe3+完全反应生成亚铁离子,即2Fe3++Cu=2Fe2++Cu2+,则加入KSCN溶液也不变色,故此种说法不正确。
(3)固体全部溶解,则一定存在Fe2O3和Cu2O,因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,反应的有关离子方程式为Fe2O3+6H+=2Fe3++3H2O、Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=2Fe2++Cu2+。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,有利于培养学生的逻辑推理能力和逆向思维能力,有助于提升学生的学科素养,提高学生的学习效率。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论,做题时注意把握题给信息。
本题难度:困难
3、选择题 向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为
A.1.14g
B.1.6g
C.2.82g
D.4.36g
参考答案:B
本题解析:略
本题难度:一般
4、简答题 三氯化铁是中学化学实验室中常用的化学试剂.某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3?6H2O晶体.填写下列空白:
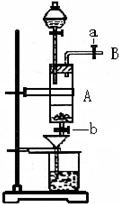
(1)收集导管B处的气体可采用的方法是______.滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______.
(2)烧杯内放过量稀HNO3的原因是______.发生反应的离子方程式是______.
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是______.
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3?6H2O,而不用直接蒸干的方法来制得晶体的理由是______
(5)你认为该实验存在的缺点可能有:______.
参考答案:(1)导管B处的气体为氢气,氢气密度比空气小且不溶于水,可用排水法或向下排空气法收集;Cu与铁形成Fe-Cu原电池使反应速率加快,
故答案为:用排水法或向下排空气法;因废铁屑中含少量Cu等杂质,形成Fe-Cu原电池使反应速率加快;
(2)过量的稀HNO3保证使Fe2+ 全部氧化成Fe3+;反应的离子方程式是3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,
故答案为:稀HNO3有强氧化性,为保证使Fe2+全部氧化成Fe3+;3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;
(3)使分液漏斗中的酸可滴入A中,故答案为:与大气相通,使分液漏斗中的酸可滴入A中;
(4)因为FeCl3是强酸弱碱盐水解,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O,
故答案为:因为FeCl3是强酸弱碱盐水FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3?6H2O;
(5)无尾气处理装置,用稀HNO3氧化FeCl2时会引入硝酸根离子使制得的FeCl3?6H2O不纯,
故答案为:反应中产生的有害气体会污染环境;用稀HNO3氧化FeCl2时会有Fe(NO3)3生成而使制得的FeCl3?6H2O不纯;
本题解析:
本题难度:一般
5、选择题 在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b <c,则下列判断正确的是
A.残余固体可能为铁、铜混合物
B.最后得到的溶液中含有Fe3+
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:A
本题解析:硫酸铁溶液中,加入a g铜其反应方程式为 ,当铜完全溶解后再加入b g铁,可能发生的反应为
,当铜完全溶解后再加入b g铁,可能发生的反应为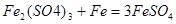 ;
;
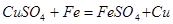 ,由于反应后得到c g残余固体,且b <c,则由反应方程式可得正确选项为A;
,由于反应后得到c g残余固体,且b <c,则由反应方程式可得正确选项为A;
本题难度:一般