1、填空题 下图表示A、B、C、D、E五种物质的相互转化关系,其中A为淡黄色固体,C为单质,D为离子化合物。

(1)写出下列转化的化学方程式: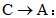 :____________;
:____________; :____________,该反应的离子方程式是______________,该反应的氧化剂是_____________,还原剂是_____________;
:____________,该反应的离子方程式是______________,该反应的氧化剂是_____________,还原剂是_____________;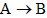 :___________,该反应的氧化剂是_______,还原剂是_____________;
:___________,该反应的氧化剂是_______,还原剂是_____________;
(2)C单质的保存方法是________________。
参考答案:(1) ;
; 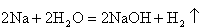 ;
;
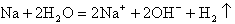 ;
;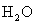 ;
;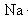 ;
;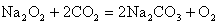 ;
;
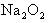 ;
;
(2)应保存在煤油中
本题解析:
本题难度:一般
2、选择题 X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;?0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol?L-1戊溶液中阴离子总的物质的量小于0.1mol
参考答案:C
本题解析:
本题难度:一般
3、简答题 X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成.X有5个原子核.通常状况下,W为无色液体.已知:X+Y
Z+W
(1)Y的电子式是?.
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是?.
(3)用如图所1示装置制备NO并验证其还原性.有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中.
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞.
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸.步骤c后还缺少的一步主要操作是?.
(4)一定温度下,将1mol?N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色.温度由T1继续升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图2所示.温度在T1~T2之间,反应的化学方程式是?.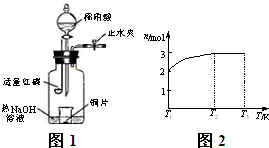
参考答案:
本题解析:
本题难度:一般
4、推断题 下图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子,Y为淡黄色固体。

(1)化学式:B为___________,F为___________。
(2)用电子式表示D的形成过程为_________________________。
(3)A是一种非常重要的工业产品。据统计,地球上每年由于腐蚀而消耗的A约占A年产量的10%。
A发生腐蚀的主要原因是(填写下同的选项序号)_______________;
a.直接与氧气发生化学腐蚀
b.通过原电池反应发生腐蚀
c.因溶于水而消耗掉。
若你选定选项a或c,请写出相应的化学方程式:____________________
若你选定选项b,请写出正极的电极反应式:____________________
(4)已知H为无色,密度比空气大的气体,则①中所涉及的反应的化学方程式为___________________
(5)写出F水溶液与足量Y反应的离子方程式:________________________
参考答案:(1)H2;FeCl2
(2)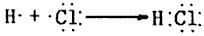
(3)b;O2+2H2O+4e-==4OH-
(4)2Na2O2+2H2O==4NaOH+O2↑;FeCl3+3NaOH==Fe(OH)3↓+3NaCl
(5)3Na2O2+4H2O+2Fe2+==2Fe(OH)3↓+O2↑+6Na++OH-
本题解析:
本题难度:一般
5、推断题 A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)A、D的化学式:
A.____________, D.____________。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B→C:________________________________________________________________________;
E→B:________________________________________________________________________;
F→C:________________________________________________________________________。
参考答案:(每空2分,共10分)? (1)A.Na D.NaCl (2)2OH-+CO2===CO +H2O
+H2O
2Na2O2+2H2O===4Na++4OH-+O2↑?CO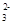 +H2O+CO2===2HCO
+H2O+CO2===2HCO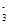
本题解析:E是淡黄色粉末,且A在氧气中点燃生成E,则E应该是过氧化钠。根据反应的条件以及转化特点可判断,A是钠,B是氢氧化钠,C是碳酸钠,D是氯化钠,F是碳酸氢钠。
点评:该题是高考中的常见题型,属于中等难度的试题。该题基础性强,难度不大。主要是考查学生对钠及其化合物性质和转化的熟悉掌握程度,有利于培养学生的逻辑推理能力和规范答题能力,也有助于提高学生的应试能力和学习效率。
本题难度:一般