|
高中化学知识点归纳《无机综合与推断》高频考点预测(2017年最新版)(八)
2018-03-17 06:31:48
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (11分)阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是?(填序号)
A.氢
B.碳
C.氧
D.硫
| 信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素?为什么?
?;?。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为?。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为? ?。 ?。
信息⑤:上述四种元素中,X与W同主族。
(5)X与浓硫酸反应的化学方程式为?。
参考答案:(1)AD(2分)
(2)是(1分),因为有一种氧化物既能溶于酸,又能溶于碱,是两性氧化物(2分)。
(3)Mg(OH)2(2分)
(4)SiO32-+2H+=H2SiO3↓(2分)
(5)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分) CO2↑+2SO2↑+2H2O(2分)
本题解析:略
本题难度:一般
2、推断题 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无气味的气体。这四种化合物具有如图所示的转化关系(部分反应物、产物及反应条件已略去)。
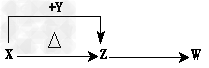
请回答:
(1)W为________分子(填“极性”或“非极性”)。
(2)X与Y在溶液中反应的离子方程式是________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图所示装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。

①装置Ⅰ中反应的化学方程式是_______________________,装置Ⅱ中物质的电子式是__________________________。
②用X含有的四种元素中的两种组成的某化合物M,在催化剂存在的条件下制备并收集纯净干燥的装置Ⅴ中的气体,该化合物M的结构式是______,所需仪器装置是________(从上图中选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是________________________。
参考答案:(1)非极性
(2)HCO3-+OH-===CO32-+H2O
(3)①Na2CO3+H2SO4===Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4===2CO2↑+Na2SO4+2H2O; ;②H-O-O-H;Ⅰ、Ⅳ、Ⅴ ;②H-O-O-H;Ⅰ、Ⅳ、Ⅴ
(4)2Na2CO3+Cl2+H2O===NaClO+NaCl+2NaHCO3
本题解析:
本题难度:一般
3、填空题 (8分) A、B、C、D四种化合物,其中A、C、D焰色反应均为黄色,而B的焰色反应为紫色,A、C和盐酸反应均得到D,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸亚铁溶液会先后出现白色沉淀E→灰绿色沉淀→红褐色沉淀F。试推断
(1)A:________、B:________、C?、 D?(填化学式)
(2) C+盐酸的离子方程式?
(3)加热C得到A的化学方程式?
参考答案:(1)A:Na2CO3? B:KOH? C:NaHCO3? D:NaCl
(2)HCO3-+H+=H2O+CO2↑?(3)2NaHCO3=△Na2CO3+H2O+CO2↑
本题解析:略
本题难度:一般
4、填空题 (12分)Mg及其化合物可以发生如下转化(部分反应物、生成物或水已略去),已知X、Y、Z为气态单质,B常温下为液态,化合物D的焰色反应为黄色,C和G混合冒白烟并生成A,电解E的水溶液常用于某种工业生产。
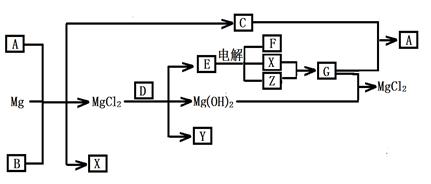
(1)写出下列物质的化学式
A???Y??
(2)写出C的电子式?
(3)写出MgCl2与D反应的化学方程式?
(4)请用水解平衡理论解释A+B+Mg→C+X+ MgCl2的原因_______________________。
(5)将0.1molCO2通入1L溶质为F的溶液中,充分反应后,再向混合液中逐滴滴加盐酸,所加盐酸的体积与生成的气体的 关系如下图所示:则原F溶液的浓度为?mol/L。 关系如下图所示:则原F溶液的浓度为?mol/L。
参考答案:

本题解析:略
本题难度:一般
5、推断题 已知A~H中均含有A元素,且是中学化学常见的物质,其中B和C为气体,H是盐,该盐溶液显酸性,且能腐蚀铜板,A~H有如下的转化关系。?

请回答下列问题:
(1)H的水溶液显酸性的原因是(用离子方程式表示)______________________
(2)写出②③的离子反应方程式②___________________?③_____________________。
(3)A与F反应可生成含有A2O32-离子的化合物,请写出该离子在E水溶液中反应的方程式____________________________。
(4)若在0.1mol·L-1H溶液中通入过量B气体,使H完全反应,此时溶液中的H+浓度是_______________mol·L-1。
(5)若向等浓度的D和H混合溶液中通入氨气先产生的沉淀是_______________,写出该反应的离子方程式___________________,看到的现象是_______________。当溶液的pH=6时,溶液中存在的阳离子是____________。[D和H生成的氢氧化物的溶度积分别为8.0×10-16和4.0×10-38,当溶液中的离子浓度小于10-5mol/L时,认为已沉淀完全。]
参考答案:(1)Fe3+ +3H2O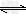 Fe(OH)3+3H+? Fe(OH)3+3H+?
(2)?②2Fe3+ +H2S=2Fe2+ +S↓+2H+?;③2Fe3+ +?SO2+2H2O=2Fe2+ +SO42-+4H+?
(3)S2O32-+2H+=?S↓+SO2↑+H2O
(4)0.2?mol·L-1。
(5)Fe(OH)3;Fe3+ +3NH3·H2O=?Fe(OH)3↓?+3?NH4+;红褐色沉淀;Fe2+ 、NH4+
本题解析:
本题难度:一般
|  ?。
?。