1、填空题 (13分).下图每一方框中的字母代表一种反应物或生成物:
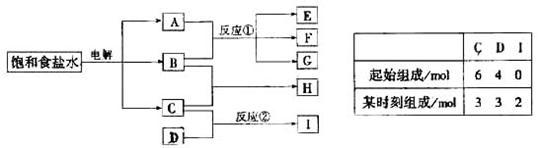
物质A跟B反应生成物质E、F和G;物质C跟D反应生成气体I,I中含有植物生长必须的元素之一,请填写下列空白:
(1)物质H的分子式是___________,气体I的分子式是____________
(2)写出电解饱和食盐水的化学方程式,并标出电子转移的方向和数目。
___________________________________________该反应中的 还原剂是___________
还原剂是___________
(3)反应①的化学方程式是_________________________________________。
参考答案:(1)HCl、NH3(2)?、NaCl(3)Cl2+2 NaOH =" NaCl+NaClO+" H2O。
本题解析:略
本题难度:一般
2、实验题 (13分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。
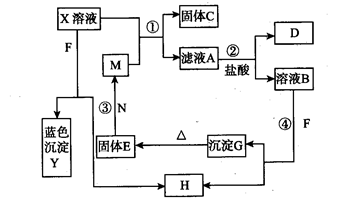
请回答下列问题:
(1)E的化学式为_______________(2分)。
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是_______________(2分)。
(3)在反应①②③④中属于置换反应的是__________(填序号)(2分)。
(4)反应②的离子方程式为______________________________________________(2分)。
(5)用石墨作电极电解50mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出电解时的阳极反应式________________________________________(2分)。
②电解后溶液的pH为_______________________________(3分)(假设电解前后溶液体积不变)。
参考答案:(1)Fe2O3(2分)? (2)铁丝上附有红色物质,溶液颜色变浅(2分)
(3)(1)(3)(2分)? (4)2Fe2++NO3-+4H+=3Fe3++NO↑+2H2O(2分)
(5)①4OH--4e-=O2+2H2O(2分)?②0(3分)
本题解析:F为淡黄色固体,可能为硫或Na2O2,它可与溶液B或溶液X均产生无色气体H及沉淀Y(蓝色沉淀必定为Cu(OH)2)或G,可判定F为Na2O2,H为氧气,X为铜盐;
由“N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器”知道N必为铝,不溶于水的氢氧化物G加热脱水生成氧化物E,E与铝可生成另一常见金属M,可知这属于铝热反应,铝与氧化物E:Fe2O3置换出M:铁单质:③2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
铁与铜盐M发生置换出C:铜和滤液A:亚铁盐溶液,加入盐酸后生成NO(D为无色气体,D在空气中会出现红棕色,说明D一定为NO,在空气中被氧化为红棕色的NO2),说明A必定为硝酸盐:②2Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,从而可知X为硝酸铜,A为硝酸亚铁,B为硝酸铁溶液;
(1)Fe2O3
(2)铁与硝酸铜发生置换反应:①Fe+CuSO4=FeSO4+Cu,故铁丝上附有红色物质,溶液颜色由蓝色转变了浅绿色
(3)反应④:2Na2O2+2H2O=4NaOH+O2↑? FeCl3+3NaOH=Fe(OH)3↓+3NaCl,①②③④属于置换反应的是①③
(4)2Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(5)总电解反应式为:2Cu(NO3)2+2H2O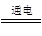 2Cu+O2↑+4HNO3
2Cu+O2↑+4HNO3
①阳极上有氧气生成:4OH--4e-=O2↑+2H2O
②由总反应式可知,铜为1.6g,同时得到n(HNO3)=0.05mol,c(HNO3)=0.05mol/0.05L=1mol/L
c(H+)=1mol/L,pH=0
本题难度:一般
3、简答题 有A、B、C、D、E五种化合物,其中A、B、C、D是含铝元素的化合物,F是一种气体,标准状况下相对于空气的密度为1.103.它们之间有下列的转化关系:
①A+NaOH→D+H2O?②B→A+H2O?③C+NaOH→B+NaCl? ④E+H2O→NaOH+F
(1)写出A、B、C、D的化学式:
A______,B______,C______,D______.
(2)写出③④的离子方程式:
①______,
④______.
参考答案:F是一种气体,标准状况下相对于空气的密度为1.103,则相对分子质量为1.103×29=32,应为O2,则E为Na2O2,A、B、C、D是含铝元素的化合物,由反应②可知A为
Al2O3,B为Al(OH)3,则C为AlCl3,D为NaAlO2,
(1)由以上分析可知A为Al2O3,B为Al(OH)3,则C为AlCl3,D为NaAlO2,故答案为:Al2O3;?Al(OH)3;?AlCl3;NaAlO2;
(2)反应③为AlCl3和NaOH的反应,反应的离子方程式为Al3++3OH-=Al(OH)3↓,
反应④为Na2O2和H2O的反应,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:Al3++3OH-=Al(OH)3↓;?2Na2O2+2H2O=4Na++4OH-+O2↑.
本题解析:
本题难度:一般
4、填空题 如图所示,已知:
①甲、乙、丙、丁四种元素均是前18号元素的单质;
②在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,分别生成X和Y,在产物中元素甲显负价;
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,分别生成Z和W,在产物中乙显负价.
请填空:(1)甲是______,乙是______.
(2)甲与丙反应生成X的化学方程式是______.
(3)乙与丁反应生成W的化学方程式是______.
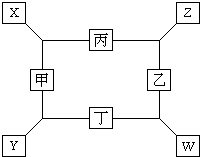
参考答案:在一定条件下甲与丙和甲与丁都按物质的量之比1:3反应,产物中元素甲显负价,说明反应后甲的化合价为-3价或-3n(n为正整数),由前18号元素的常见价态可知,反应后甲的化合价为-3价,甲为N2;与N21:3反应的单质有H2、Mg,丙与丁是H2和Mg.在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,产物中乙显负价,说明反应后乙的化合价为-2价或-2n(n为正整数),由前18号元素的常见价态可知,反应后甲的化合价为-2价.甲为O2或S,O2与H2、Mg都可都按物质的量之比1:2反应,但S与H2、Mg反应时,他们的物质的量之比是1:1,因而乙是O2.由于丙、丁不能确定谁是H2或Mg,所以甲与丙反应生成X的化学方程式是N2+3Mg=Mg3N2或N2+3H2=NH3;乙与丁反应生成W的化学方程式是O2+2H2=2H2O或2Mg+O2=2MgO;
(1)分析判断可知,甲为N2,乙为O2 ,故答案为:N2;O2;
(2)甲与丙反应生成X的反应可以是氮气和镁的反应,也可以是氮气和氢气的反应,反应的化学方程式是N2+3Mg点燃.Mg3N2(N2+3H2催化剂.高温高压NH3),
故答案为:N2+3Mg点燃.Mg3N2(N2+3H2催化剂.高温高压NH3);
(3)乙与丁反应生成W的反应是氧气和氢气的反应或镁和氧气反应生成氧化镁的反应,反应的化学方程式是O2+2H2点燃.2H2O(2Mg+O2点燃.2MgO),
故答案为:O2+2H2点燃.2H2O(2Mg+O2点燃.2MgO).
本题解析:
本题难度:一般
5、填空题 已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
粒子代码
| a
| I
| e
|
原子核数
| 单核
| 四核
| 双核
|
粒子的电荷数
| 一个单位正电荷
| 0
| 一个单位负电荷
|
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:?
(1)写出下列物质的化学式:B??J?。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M?。?②I溶于G ?。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为?。
参考答案:(1)Cl2 ;NO? (2) ①H+ +ClO-= HClO
(3)NH3+H2O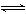 NH3·H2O
NH3·H2O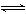 NH4++OH-
NH4++OH-
(4)2HCl(g)=H2(g)+Cl2(g);△H=" +184.6" kJ·mol-1
本题解析:根据a、I、e的结构特点可知a是钠离子,I是氨气,e是OH-,所以A是氢氧化钠。电解能够生成氢氧化钠的是电解饱和的食盐水,即B是氯气,C是氢气,H是氯化氢,则M水次氯酸,所以E是次氯酸盐。次氯酸分解生成氧气和氯化氢。I是氨气,所以D是氮气,氨气催化氧化生成NO和水,所以K是氧气,J是NO,G是水,因此F是氯化钠。
本题难度:一般