1、选择题 在粗盐提纯的实验中,蒸发时正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中出现大量固体时即停止加热
参考答案:D
本题解析:
本题难度:一般
2、选择题 若不小心误将水加入你家里的食用花生油里,你将采用下列何种方法分离
A.过滤
B.分液
C.渗析
D.萃取
参考答案:B
本题解析:食用花生油和水为互不相溶且密度不同的两种液体,可用分液的方法分离。A、过滤用于固体和液体分离,错误;B、食用花生油和水为互不相溶且密度不同的两种液体,可用分液的方法分离,正确; C、渗析用于胶体的精制,错误;D、萃取是利用物质在不同溶剂中溶解度不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来,食用花生油和水两种物质互不相溶,分层,不能用萃取的方法分离,错误。
本题难度:简单
3、实验题 TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下:

有关性质如下表
物质
| 熔点/℃
| 沸点/℃
| 其他
|
CCl4
| -23
| 76
| 与TiCl4互溶
|
TiCl4
| -25
| 136
| 遇潮湿空气产生白雾
|
仪器A的名称是?,装置E中的试剂是?。反应开始前依次进行如下操作:组装仪器、?、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为?(填序号)。欲分离D中的液态混合物,所采用操作的名称是?。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l)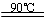 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
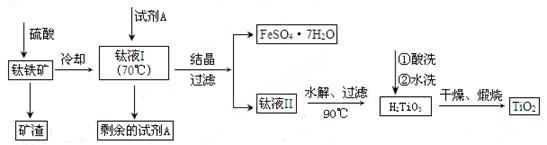
①试剂A为?。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是?。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是?。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是?(填化学式)。
参考答案:(1)干燥管;浓硫酸;检查气密性;②③①,分液(或蒸馏)
(2)①Fe?温度过高会导致TiSO4提前水解,产生H2SiO3沉淀
②Fe2+,Fe2O3
本题解析:(1)仪器A是干燥管,由于IiCl4遇到水蒸气会水解,所以E中用浓硫酸吸收空气中水蒸气。对于气体制取而言,组装仪器、检查气密性、加药品,终止实验时防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2。分离两种沸点不同的液体混合物应该用蒸馏法。
(2)①矿石经硫酸溶解后得到的Fe2(SO4)3,而后过滤得到的是FeSO4·7H2O,所以试剂A是铁粉,把Fe3+还原为Fe2+。因为TiOSO4容易水解,若温度过高,则会有较多TiOSO4水解为固体H2TiO3,而经过滤进入FeSO4·7H2O中导致TiO2产率降低。
②加入KSCN溶液无现象,加H2O2出现红色,说明存在Fe2+,经过加热后Fe2+氧化为Fe2O3,而使产品发黄。
本题难度:一般
4、选择题 要除去食盐水中少量泥沙,可采用的实验方法是
A.过滤
B.结晶
C.萃取
D.蒸馏
参考答案:A
本题解析:不溶性固体和液体的分离方法,可以用过滤。蒸馏是分离沸点不一样的两种液体。
本题难度:简单
5、选择题 下列除杂质选用试剂错误的是( )
| 编号 | 物质 | 杂质 | 试剂
A
CO2
HCl
饱和碳酸钠溶液
B
Cl2
HCl
饱和食盐水
C
SiO2
Fe2O3
盐酸
D
Fe
Al
氢氧化钠溶液
|
A.A
B.B
C.C
D.D
参考答案:A.二氧化碳、HCl均与碳酸钠反应,将原物质除去,不符合除杂原则,故A错误;
B.HCl极易溶于水,饱和食盐水抑制氯气的溶解,则可除去氯气中的HCl,故B正确;
C.氧化铁与盐酸反应,而二氧化硅不与盐酸反应,溶解后过滤即可实现除杂,故C正确;
D.Al与NaOH溶液反应,而Fe不能,反应后过滤即可实现除杂,故D正确;
故选A.
本题解析:
本题难度:简单