1、选择题 右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是(?)
 ?
?
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:W>R
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
参考答案:D
本题解析:根据元素的特征化合价可知,X为O,Y为Na,Z为Al,W为S,R为Cl。原子半径:Y>Z>X,A错误。气态氢化物的稳定性:W<R,B错误。WX3与水反应的产物H2SO4是共价化合物,C错误。Y和Z的最高价氧化物对应的水化物NaOH和Al(OH)3能相互反应,D正确。
点评:主要考查短周期元素化合价与原子序数的关系图推测该元素的性质,难度不大,解题的关键是结合关系图,找出对应的元素,即可解答。
本题难度:简单
2、选择题 下列变化规律错误的是
A.微粒半径:F-<Cl-<Br-<I-
B.稳定性:HI<HBr<HCl<HF
C.沸点:HF<HCl<HBr<HI
D.阴离子还原性:F-<Cl-<Br-<I-
参考答案:C
本题解析:由于HF分子中含有氢键,所以沸点比其他的卤化氢的沸点高。
本题难度:一般
3、选择题 下列各组物质,按化合物、单质、混合物顺序排列的是
A.烧碱、液态氧、铁矿石
B.生石灰、白磷、熟石灰
C.干冰、铜、氯化氢
D.空气、氮气、胆矾
参考答案:A
本题解析:由两种或两种以上元素组成的纯净物是化合物,只由一种元素组成的纯净物是单质,而由不同种物质组成的是混合物,因此选项A正确;B中熟石灰是氢氧化钙,属于化合物;C中氯化氢也是化合物;D中空气是混合物,胆矾是化合物,答案选A。
考点:考查物质的分类
点评:关于化合物、单质、混合物的正误判断的关键是准确理解有关化学概念,把握好内延和外涵,例如由一种元素组成的不一定是单质,比如氧气和臭氧等。
本题难度:一般
4、填空题 (7分)氮元素可以形成多种化合物。
(1)基态氮原子的价电子轨道表示式是 。
(2)已知尿素的结构式为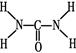 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是;
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
当肼燃烧放出519.35kJ热量时,形成的π键有mol。
参考答案:(1) (2分)(2)sp2(1分)sp3(1分)
(2分)(2)sp2(1分)sp3(1分)
(3)①三角锥形(1分)②3(2分)
本题解析:(1)氮元素的核外电子数是7个,则根据核外电子排布规律可知基态氮原子的价电子轨道表示式是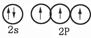 。
。
(2)根据尿素的结构简式可知,分子中氮元素全部形成单键,因此是sp3杂化;碳元素形成2个单键,1个双键,因此是sp2杂化。
(3)①氨气分子中氮原子的价层电子对数=4,其中有一对孤对电子,所以氨气是三角锥形。
②当肼燃烧放出519.35kJ热量时,根据热化学方程式可知生成氮气的物质的量是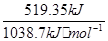 ?×3=1.5mol。氮气分子中含有2个π键,则π键的物质的量是3mol。
?×3=1.5mol。氮气分子中含有2个π键,则π键的物质的量是3mol。
本题难度:一般
5、填空题 (11分)A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为?。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为?;分子的VSEPR模型名称为?;阴离子的立体构型为___?__。
(2)G的价电子排布式为?。用电子式表示化合物AE2的形成过程?。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为 和 ? (填化学式)。
(4)E有多种含氧酸根①EO-?②EO2-?③EO3-?④EO4-,其中空间构型为四面体型的是?。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)?
参考答案:(1)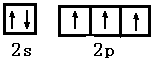 ? sp3?正四面体?角型
? sp3?正四面体?角型
(2)3d84s2?

(3)0? N2? CN-?(4)④
(5)CO2、NCl3、CCl4、COCl2、N≡C-C≡N等中的任意2个
本题解析:A的基态原子外围电子排布式为3s2,所以A是镁元素。B原子的L电子层的P能级上有一个空轨道,因此B是碳元素。C元素的基态原子最外层有3个未成对电子,次外层有2个电子,则C是氮元素。D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反,所以D是氧元素。E是海水中除氢、氧元素外含量最多的元素,则E是氯元素。F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2,则属于第Ⅷ,分别是铁和镍。
本题难度:一般