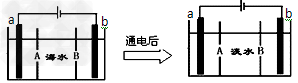
1、选择题 电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示。已知海水中含
Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。下列叙述中正确的是
[? ]
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,a电极的电极反应式为?4OH--4e-?=O2↑?+2H2O
D.通电后,b电极上产生无色气体,溶液中出现少量白色沉淀
2、实验题 (9分)利用下图电解装置进行实验。

(1)若a、b是惰性电极,电解质溶液是氯化钠溶液,a极是?极,总反应的离子方程式是?。
(2)若a、b是惰性电极,电解质溶液是硝酸银溶液,b极上的现象是?,总反应的离子方程式是?。
(3)若a、b是惰性电极,电解质溶液是硫酸钾溶液,a极上的电极反应是?,若两极附近分别加入石蕊试液,两极附近的现象是?。
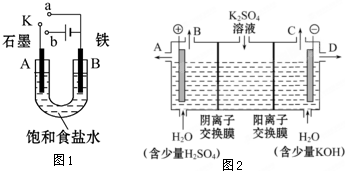
3、简答题 某课外活动小组用如图1装置进行实验,试回答下列问题.
(1)若开始时开关K与a连接,则B极的电极反应式为______.
(2)若开始时开关K与b连接,则B极的电极反应式为______,总反应的离子方程式为______.有关上述实验,下列说法正确的是(填序号)______.
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾.
①该电解槽的阳极反应式为______.
此时通过阴离子交换膜的离子数______(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数.
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为______.
4、选择题 已知氧元素有16O、18O两种核素,按中学化学知识要求,下列说法正确的是
[? ]
A.Na2O2与H218O反应时生成产生18O2气体
B.向2SO2(g)+O2(g)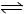 2SO3(g)的平衡体系中加入18O2,结果18O2 只出现在产物中
2SO3(g)的平衡体系中加入18O2,结果18O2 只出现在产物中
C.CH3COOH和CH3CH218OH发生酯化反应时,产物中分子式为H218O
D.用惰性电极电解含有H218O的普通水时,阳极可能产生三种相对分子质量不同的氧分子
5、填空题 (1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
①电解一段时间后,B中出现浑浊现象,请用离子方程式表示原因______.
此时电极a附近的现象为______,因此工业上电解所用的食盐水需精制.
②随反应的进行,C中溶液红色褪去,主要原因有两种可能.请按要求填写表格.
| 假设 | 主要操作 | 现象 | 结论
假设1: | | |
假设2:可能是H+与OH-中和,导致溶液褪色
|
(2)电解饱和食盐水所得气体X,可应用于提取溴单质.现有流程图如下:
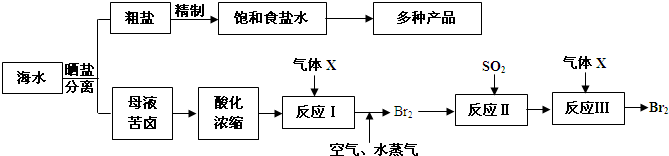
请回答:
①气体X的化学式为______,反应II的化学方程式为__ ____.
②在母液苦卤中含有较多的NaCl、KCl、MgCl2、MgSO4等物质.用沉淀法测定苦卤中镁元素的含量(g/L),实验过程中应测定的数据有______.
③电解200kg?质量分数为25%的饱和食盐水,当浓度下降到20%时,收集到氯气的物质的量为______(溶于溶液中的氯气忽略不计,计算结果保留一位小数).