1、填空题 (1)鉴别KCl溶液和K2CO3的试剂是 ,离子方程式为? 。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 ? 。
参考答案:(1)盐酸、CO32-+2H+===CO2↑+H2O;
(2)盐酸、HCO3-+H+===CO2↑+H2O;
(3)加热、2NaHCO3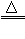 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
本题解析:
本题难度:一般
2、实验题 (20分)下图是两个实验装置(铁架台等辅助仪器略去未画)②原混合物中碳酸钠的质量分数。
参考答案:(20分)
(1)Ⅱ,Ca2+ +2OH— +CO2===CaCO3↓+H2O,Na2CO3(各2分)
(2)2Na2O2+2CO2===2Na2CO3+O2;该反应能放出大量的热。(各2分)
本题解析:(1)碳酸氢钠受热分解产生二氧化碳,二氧化碳能使澄清石灰水变浑浊;碳酸钠受热不分解,即使融化也不分解。碳酸钠更加稳定!
(2)棉花燃烧,说明该反应为放热反应,过氧化钠和二氧化碳气体反应产生氧气,氧气可以助燃。

本题难度:一般
3、选择题 为除去下列物质所含的杂质(括号内的物质),有关除杂试剂和操作合理的是
A.乙醇(水):加氢氧化钙固体,过滤
B.乙酸乙酯(乙酸):加氢氧化钠溶液,分液
C.溴水(溴化钠):除杂过程中涉及的操作有:加CCl4,萃取、分液
D.苯甲酸(苯甲酸钠):加稀硫酸,蒸馏
参考答案:C
本题解析:解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则,据此可以解答。A、乙醇与水互溶,所以要除去乙醇溶液中的水需要加入生石灰,然后蒸馏即可,A不正确;B、乙酸乙酯也能和氢氧化钠溶液反应,所以要除去乙酸乙酯中的乙酸,需要加入饱和碳酸钠溶液,然后分液即可,B不正确;C、单质溴易溶在有机溶剂中,因此要除去溴水中的溴化钠,可以利用萃取,因此除杂过程中涉及的操作有:加CCl4,萃取、分液,C正确;D、要除去苯甲酸中的苯甲酸钠有关加入浓硫酸,然后蒸馏即可,D不正确,答案选C。
本题难度:一般
4、填空题 在溴水中加入汽油,充分振荡后,上层溶液的颜色为?,原因是?。要把这两层液体分开,用到的玻璃仪器是?,进行的实验操作是?。
参考答案:橙色? Br2易溶于汽油?分液漏斗?分液
本题解析:略
本题难度:简单
5、填空题 二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题以此粉末为原料,资源回收的工艺流程如下:

(1)写出第①步反应的离子方程式?。
(2)洗涤滤渣B的目的是为了除去____(填离子符号),检验该离子是否洗净的方法是?。
(3)写出第③步反应的化学方程式_____________________________。
(4)制备绿矾(FeSO4·7H2O)时,向Fe2(SO4)3溶液中加入过量铁屑,充分反应后,经过滤得到FeSO4溶液,再经?、?、过滤、洗涤、干燥等操作步骤得到绿矾。
(5)取上述流程中得到的Ce(OH)4产品(质量分数为97%)1.0g,加硫酸溶解后,用0.1000mol/LFeSO4溶液滴定至终点(铈被还原成Ce3+),则需准确滴加标准溶液的体积为?mL。?
参考答案:(1)SiO2+2OH-=SiO32-+H2O(2分)
(2)Fe3+(2分);取最后一次洗涤液,加入KSCN溶液,若不出现红色,则已洗净;否
则未洗净(2分,其他合理答案给分)?
(3)2CeO2+ H2O2 + 3H2SO4= 2Ce2(SO4)3 + O2↑+ 4H2O(2分)
(4)蒸发浓缩、冷却结晶(每空1分,共2分)
(5)46.63(2分,需保留小数点后两位)
本题解析:这是一道常见的物质提纯的题。(1)加入强碱是为了除去其中的二氧化硅;(2)洗涤滤渣的目的是为了除去三价铁离子;用硫氰化钾来检验是否除净了三价铁离子;(3)这一步是用过氧化氢来还原二氧化铈,二氧化铈被还原为正三价,过氧化氢被氧化为氧气;(4)结晶的过程总是得蒸发浓缩冷却结晶;
(5)2Ce(OH)4+2FeSO4+4H2SO4=Ce2(SO4)3 + Fe2(SO4)3+11H2O
416g ?2mol
0.97g?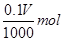
416g×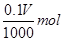 =0.97g×2mol
=0.97g×2mol
解之得:V=46.63 mL
本题难度:困难