1、选择题 将1摩氨气和2摩氧气混和,在800℃铂催化剂作用下充分反应,当恢复到常温常压时,所得的产物是(?)
13.?A?二氧化氮与氧气? B?一氧化氮与二氧化氮
14.?C?硝酸与一氧化氮? D?硝酸与水
参考答案:D
本题解析:略
本题难度:一般
2、实验题 某化学兴趣小组利用图一装置制取氨气并探究氨气的有关性质。
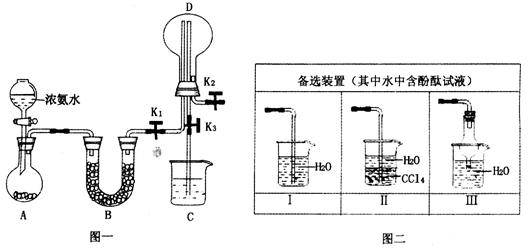
(1)装置A中烧瓶内试剂可选用________(填序号)
a.碱石灰? b.浓硫酸? c.生石灰? d.五氧化二磷? e.烧碱
(2)若探究氨气的溶解性,需在K2的导管末端连接图二装置中的_____装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________
___________________________________________________________________________。
(3)若探究氨气的还原性,需打开K1、K2,K3处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气,生成气体必须通过盛有____________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为___________________________________;
③从K3处导管逸出的气体中含有少量Cl2,则C装置中应盛放_________溶液(填化学式),反应的离子方程式为____________________________________。
参考答案:(1)ace(2分,全对得2分,错选不得分)
(2)Ⅱ或Ⅲ(2分)用热毛巾将烧瓶捂热(1分)
(3)①饱和食盐水、浓硫酸(2分)
②3Cl2+8NH3=6NH4Cl+N2(2分,分布写也可)
③NaOH(1分)Cl2+2OH?=Cl?+ClO?+H2O
本题解析:(1)碱石灰、生石灰、烧碱都能促进浓氨水中氨气的挥发,故ace正确。
(2)Ⅱ或Ⅲ能防止氨气的倒吸;因为装置中没有胶头滴管,所以用热毛巾捂热烧瓶,使氨气膨胀,与水接触溶解,形成喷泉。
(3)①制取的氯气中含氯化氢、水分,用饱和食盐水可除氯化氢、用浓硫酸可除水分,得到纯净、干燥的氯气。②产生的白烟为氯化铵,无色无味的气体为氮气,配平既得方程式。③氯气有毒,会污染环境,故用氢氧化钠溶液吸收尾气中的氯气,防止污染。
本题难度:一般
3、选择题 下列关于铵盐的叙述中不正确的是( )
A.由于含有离子键,所以都是离子化合物
B.受热都能分解出氨气
C.都易溶于水
D.都可以与碱反应放出氨气
参考答案:B
本题解析:铵盐含有离子键、共价键和配位键,含有离子键一定是离子化合物。铵盐不稳定,受热易分解,但不同铵盐受热分解产物不同。NH4NO3受热分解时,产物中没有NH3生成。C、D为铵盐的通性。
本题难度:简单
4、选择题 一种盐X与氢氧化钠共热,可放出无色气体Y,Y经过一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的(?)
A.(NH4)2SO4
B.NH4NO3
C.NH4Cl
D.NH4HCO3
参考答案:B
本题解析:与氢氧化钠共热放出的无色气体Y一定是NH3,NH3经过一系列氧化后生成NO2,NO2溶于水可得HNO3,NH3和HNO3得到NH4NO3。
本题难度:一般
5、选择题 在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为(?)
A.1:1
B.3:2
C.2:1
D.4:1
参考答案:B
本题解析:设生成的NO的质量为5.6—3.2=2.4g,物质的量为 =0.08mol
=0.08mol
设溶液中Fe2+和Fe3+物质的量分别为a、b
两者的总物质的量为a+b= =0.1
=0.1
由电子的得失守恒可知2a+3b=0.08×3
可知a=0.06mol? b=0.04mol
故答案为B
本题难度:一般