1、选择题 将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是(?)
①1.2mL? ②2.4mL? ③3.6mL? ④4mL
A.①②
B.①③
C.②④
D.①④
参考答案:D
本题解析:2ml的无色气体,不是O2就是NO (NO2为棕红色 也不可能是O2和NO混合气,混合气反应产生NO2)。
(1)剩余O2,NO2和O2反应,O2过量2ml,剩下10ml为O2和NO2的混合气,反应4NO2+O2+2H2O=4HNO3,NO2/O2=4/1,
参加反应的O2为2ml,O2共4ml。
(2)剩余2ml NO,O2完全反应,设O2体积为Xml,则NO2体积为(12-X) ml,Xml的O2可以使4Xml的NO2全部生成硝酸不产生NO,剩下(12-5X) ml的NO2在没有O2的情况下 3NO2+H2O=2HNO3+NO,产生(12-5X)/3ml的NO,(12-5X)/3=2,
X=1.2ml。故选D。
点评:本题考查的是二氧化氮和一氧化氮的性质及其计算,学生要熟练书写出发生的化学方程式,再结合假设法,进行计算,解答本题。
本题难度:简单
2、选择题 0.75 mol·L-1的NaOH溶液200 mL和0.5 mol·L-1的H3PO4溶液200 mL混合,生成盐的物质的量浓度接近(?)
A.NaH2PO4和Na2HPO4溶液的浓度均为0.2 mol·L-1
B.Na2HPO4和NaH2PO4溶液的浓度均为0.125 mol·L-1
C.0.15 mol·L-1的Na2HPO4和0.10 mol·L-1的NaH2PO4
D.0.1 mol·L-1的Na2HPO4和0.1 mol·L-1的Na3PO4
参考答案:B
本题解析:n(NaOH)="0.75" mol·L-1×0.2 L="0.15" mol
n(H3PO4)="0.5" mol·L-1×0.2 L="0.1" mol,则n(NaOH)∶n(H3PO4)=3∶2,可写出方程式:
2H3PO4+3NaOH====Na2HPO4+NaH2PO4+3H2O,故n(Na2HPO4)=n(NaH2PO4)=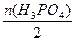 ="0.05" mol,c(Na2HPO4)=c(NaH2PO4)=
="0.05" mol,c(Na2HPO4)=c(NaH2PO4)= ="0.125" mol·L-1。
="0.125" mol·L-1。
本题难度:简单
3、选择题 不需要放入棕色瓶存放的溶液是(? )
A.浓硫酸
B.浓硝酸
C.浓氨水
D.硝酸银
参考答案:A
本题解析:见光易分解的物质一般需要保存在棕色瓶中,在4个选项中浓硫酸稳定,不易分解,所以答案是A。
本题难度:简单
4、实验题 (10分)碘在工农业生产和日常生活中有重要用途。
(1)右图为海带制碘的流程图。
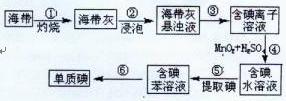
步骤③和⑤的实验操作名称分别是?、?;
步骤④中发生反应的离子方程式为?;
若步骤⑤采用四氯化碳来提取碘,将四氯化碳加入含碘水溶液中并振荡,观察到的现象是?。
(2)把滤纸用淀粉和碘化钾溶液浸泡,晾干后就是实验室常用的淀粉碘化钾试纸。利用淀粉碘化钾试纸可检验具有某种特性的气体。你认为淀粉碘化钾试纸用于检验具有?的气体(填序号)
A.酸性
B.碱性
C.氧化性
D.还原性