1、简答题 V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如图1所示:
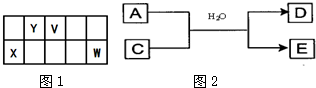
V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝.Z是人体血红蛋白中存在的金属元素.请填写下列空白:
(1)W的原子结构示意图为______;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应只生成两种化合物,这两种化合物均由两种元素组成.其反应的化学方式______;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如图2的反应关系:若E为白色沉淀,则E物质的化学式为______;
(4)含同价态X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素分别沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp〔X(OH)n〕______(填“>”或“<”)ksp〔Z(OH)n〕;
(5)联氨(N2H4)也叫做肼,是重要的火箭燃料.以次氯酸钠溶液氧化M,能获得肼的稀溶液.其反应的离子方程式为______.同温同压下,将?a?L?M气体和b?L?N气体通入水中,若所得溶液的pH=7,则a______b(填“>”或“<”或“=”).
参考答案:V、W的最简单气态氢化物M、N混合时有白烟生成,应为NH4Cl,M能使湿润的pH试纸变蓝,应为NH3,则N为HCl,所以V为N元素,W为Cl元素,根据四种元素在周期表中的位置可知X为Al元素,Y为C元素,Z是人体血红蛋白中存在的金属元素,应为Fe元素,则
(1)W为Cl元素,原子核外有3个电子层,最外层电子数为7,则原子结构示意图为
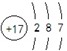
,故答案为:
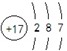
;?
(2)二氧化钛(TiO2)与Al的单质、C的单质高温下反应只生成两种化合物,这两种化合物均由两种元素组成,应为Al2O3和TiC,则反应的化学方程式为
4Al+3TiO2+3C?高温?.??2Al2O3+3TiC,故答案为:4Al+3TiO2+3C?高温?.??2Al2O3+3TiC;?
(3)含Al的化合物与CO2在水溶液中发生反应生成白色沉淀,应为AlO2-和CO2的反应,生成沉淀为Al(OH)3,故答案为:Al(OH)3;
(4)X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,在离子浓度相同的情况下,加入NaOH时,Z(OH)n先生成沉淀,则说明ksp〔X(OH)n〕>ksp〔Z(OH)n〕,
ksp越小的物质,越易生成沉淀,故答案为:>;
(5)次氯酸钠溶液氧化NH3,能获得肼的稀溶液,反应的离子方程式为ClO-+2NH3=N2H4+Cl-+H2O,如果等物质的量混合NH3和HCl,完全反应生成NH4Cl,溶液呈酸性,若所得溶液的pH=7,则NH3应过量,即a>b,故答案为:ClO-+2NH3=N2H4+Cl-+H2O;>.
本题解析:
本题难度:一般
2、填空题 现有X、Y、Z三种非金属元素,A、B、C三种金属元素,有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,火焰呈苍白色。产物XZ的水溶液可使石蕊试液变红。
(3)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2?Y,X2Y常温下为液体。
(4)Z的单质溶于X2Y中所得溶液具有漂白性。
(5)A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈黄色溶液。
(6)B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解。
(7)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色固体M。
请完成下列问题:
①写出下列物质的化学式:XZ??,X2Y??,M?。
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是 ?(填化学式)
③A的单质与Z的单质反应的化学方程式:?
④BZ3与过量的NaOH溶液反应的离子方程式:??。
⑤X单质与Z单质的混合气体经点燃充分反应后,冷却至室温,再通入足量的NaOH溶液中,气体被完全吸收,求原混合气体中X单质与Z单质的体积比可能为?。
参考答案:①HCl? (1分)? H2O? (1分)? Na2O2?(1分) ?②HClO? (2分)
③2Fe+3Cl2?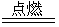 2FeCl3?(2分)
2FeCl3?(2分)
④Al3++4OH-?=AlO2-?+? 2H2O? (2分)
V(X)?:? V(Z)?≦? 1?(3分)
本题解析:X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ易溶于水,XZ的水溶液可使石蕊试液变红,说明X为H元素,Z为Cl元素,形成的化合物为HCl。两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体,应为H2O,则Y为O元素。A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈棕黄色溶液,该棕红色固体为FeCl3,则A为Fe元素。B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解。,BZ3为AlCl3,B为Al。C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色,该淡黄色固体为Na2O2,则C为Na。①由以上分析可知,XZ为HCl,X2Y为H2O,BZ2为CuCl2,淡黄色固体M为Na2O2。②Cl的单质溶于H2O中反应生成HCl和HClO,其中HClO具有漂白性。③Fe在Cl2中燃烧生成,反应的化学方程式为2Fe+3Cl2 2FeCl3。④BZ3与过量的NaOH溶液反应的离子方程式:Al3+?+? 4OH-?=? AlO2-?+? 2H2O。⑤由于过量的氯气还能发生反应2NaOH+Cl2=NaCl+NaClO+H2O,而氢气不能发生此反应,要保证气体完全被吸收只要确保氢气和氯气的体积比小于等于1就行。
2FeCl3。④BZ3与过量的NaOH溶液反应的离子方程式:Al3+?+? 4OH-?=? AlO2-?+? 2H2O。⑤由于过量的氯气还能发生反应2NaOH+Cl2=NaCl+NaClO+H2O,而氢气不能发生此反应,要保证气体完全被吸收只要确保氢气和氯气的体积比小于等于1就行。
本题难度:一般
3、简答题 A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B.用圆底烧瓶收集干燥的B,按图1装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;实验室也可用A与浓H2SO4反应制无色气体C,C气体能使品红溶液褪色.用圆底烧瓶收集干燥的C,仍按图1装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
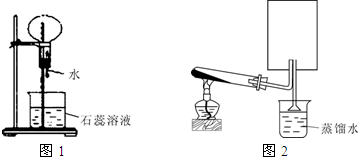
(1)A晶体的化学式是______,B气体的化学式______
(2)图2是制取并收集气体B的部分装置,在图中方框内绘出用圆底烧瓶收集B的仪器装置简图,图中倒置漏斗的作用______
(3)若用一支试管来收集B,检验B气体是否收集满的方法及现象是______.
参考答案:(1)A与NaOH反应生成气体,该气体能使石蕊试液变蓝,说明该气体为NH3,则A应为铵盐,C气体能使品红褪色,应为SO2,则A应为亚硫酸氢盐或亚硫酸盐,所以A为(NH4)2SO3或NH4HSO3,
故答案为:(NH4)2SO3或NH4HSO3;NH3;
(2)氨气极易溶于水,且密度比空气小,应用向下排空气法收集,可用

装置收集,为防止倒吸,应用倒置漏斗贴近液面进行尾气吸收,故答案为:

;防倒吸;
(3)氨气水溶液呈碱性,能使湿润的红色石蕊试纸变蓝,则验满方法可为将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满,
故答案为:将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满.
本题解析:
本题难度:一般
4、填空题 已知单质A、B、C、D有如下的反应关系.其中A?在B中燃烧时,火焰呈苍白色;?C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
(1)请写出下列物质的化学式:A______、D______、E______.
(2)Fe和气体B的反应时,氧化剂和还原剂的物质的量之比为______.
(3)请写出A和G在加热下反应的化学方程式:______.
(4)请写出G和F的水溶液反应的离子方程式:______.
(5)把过氧化钠加入E的水溶液中反应的现象为:______.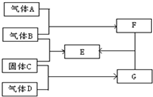
参考答案:A在B中燃烧时,火焰呈苍白色,则F为HCl,C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,则E为CuCl2,所以C为Cu,B为Cl2,从而可知A为H2,再由G是一种黑色固体,则G为CuO,所以D为O2,
(1)综上所述,A为H2,D为O2,E为CuCl2,故答案为:H2;O2;CuCl2;
(2)Fe与氯气反应的化学反应方程式为2Fe+3Cl2?点燃?.?2FeCl3,则氧化剂(Cl2)和还原剂(Fe)的物质的量之比为3:2,故答案为:3:2;
(3)A和G在加热下反应的化学方程式为H2+CuO?△?.?Cu+H2O,故答案为:H2+CuO?△?.?Cu+H2O;
(4)G和F的水溶液反应的离子方程式为CuO+2H+=Cu2++H2O,故答案为:CuO+2H+=Cu2++H2O;
(5)过氧化钠加入E的水溶液中,过氧化钠与水反应生成氧气和NaOH,然后NaOH与CuCl2反应生成氢氧化铜蓝色沉淀,则现象为产生无色气泡,有蓝色沉淀生成,
故答案为:产生无色气泡,有蓝色沉淀生成.
本题解析:
本题难度:一般
5、简答题 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图1所示(图中有些反应的生成物和反应的条件没有标出).
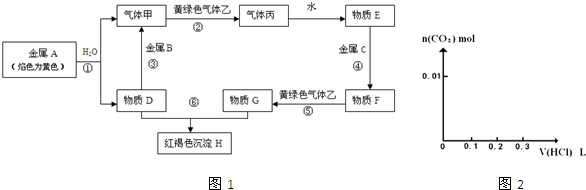
请回答下列问题:
(1)写出下列物质的化学式:B______、丙______、乙______.
(2)写出下列反应的离子方程式:
反应①______;
反应⑤______;
反应⑥______.
(3)将0.4gD和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸.在如图2所示的坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.______.
参考答案:金属A颜色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,C为Fe,
(1)由上述分析可知,B为Al,丙为HCl,乙为Cl2,故答案为:Al;HCl;Cl2;
(2)反应①为2Na+2H2O=2Na++2OH-+H2↑,反应⑤为Cl2+2Fe2+=2Fe3++2Cl-,反应⑥为Fe3++3OH-=Fe(OH)3↓,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Fe2+=2Fe3++2Cl-;Fe3++3OH-=Fe(OH)3↓;
(3)0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸,先发生NaOH+HCl=NaCl+H2O,消耗0.1L盐酸,然后发生Na2CO3+HCl=NaCl+NaHCO3,消耗0.1L盐酸,且不生成二氧化碳,最后发生NaHCO3+HCl=NaCl+H2O+CO2↑,消耗0.1L盐酸生成0.01mol二氧化碳,如图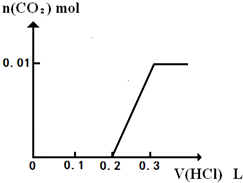 ,
,
故答案为: .
.
本题解析:
本题难度:一般