1、填空题 (14分)I.? A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、? F六种物质中均含同一种元素。请填写下列空白:
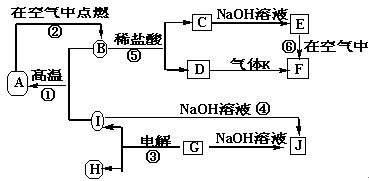
(1)A、B、C、D、E、F六种物质中含有的同一种元素在周期表中位置?,
(2)写出反应④的离子方程式?。
(3)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的
pH?7?(填“>”、“<”或“=”),用离子方程式表示其原因:??。
II.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
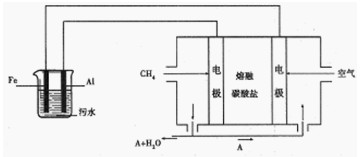
(1)电解池阳极的电极反应分别是
①?;②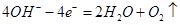 。
。
(2)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是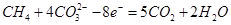 。
。
①正极的电极反应是?。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是?。
(3)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)??L。
参考答案:I. (1)第四周期、第Ⅷ族(1分)
(2)2Al+2OH-+6H2O====2[Al(OH)4]- +3H2↑?(2分)
(3)<(1分)? NH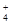 +H2O
+H2O 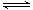 ?NH3·H2O+H+?(2分)
?NH3·H2O+H+?(2分)
II. (1)Fe-2e-=Fe2+? (2分)
(2)①O2+2CO2+4e-=2CO32-? (2O2+4CO2+8e-=4CO32-)? (2分)?②CO2?(2分)
(3)11.2? (2分)
本题解析:I根据图中的转化关系可以看出,含有的这种元素应是变价的金属元素,常见的是铁元素,即A、B、C、D、E、F分别是Fe、Fe3O4、FeCl2、FeCl3、Fe(OH)2、Fe(OH)3。G能溶于氢氧化钠溶液,常见的固体化合物是三氧化二铝,则I是铝,H是氧气,反应①是铝热反应。
Ⅱ根据燃料电池可得出铁是阳极,铝是阴极,阳极反应式为Fe-2e-=Fe2+。在燃料电池中氧气通入正极发生还原反应,由于是以熔融碳酸盐为电解质,所以正极反应式为O2+2CO2+4e-=2CO32。。根据正极和负极的电极反应式可知该物质是二氧化碳。阴极产生氢气,物质的量是2mol,转移电子4mol,1mol甲烷失去8电子,根据得失电子守恒知消耗甲烷0.5mol,其体积是11.2L。
本题难度:一般
2、选择题 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是
[? ]
A.X、Y、Z一定是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.若X、Y都为金属单质,则Z必为非金属单质
D.若甲为FeI2,则乙可能为FeCl2
参考答案:C
本题解析:
本题难度:一般
3、简答题 如图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去.A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味的气体.回答下列问题.
(1)物质A的名称是:______
(2)写出物质B的一种主要用途:______
(3)写出工业上制取气体B的化学方程式:______
(4)实验室收集EF的方法:E______D______.
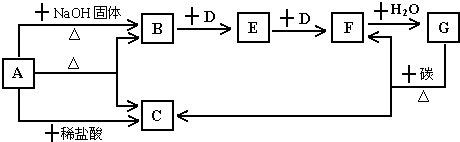
参考答案:A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体是NH3,是A和氢氧化钠反应生成,说明A中含铵根离子,B和D发生两部连续反应,说明D是无色无味的气体O2,E为NO,F为NO2,G为HNO3,G和C反应生成二氧化氮和二氧化碳,所以C为CO2,A是一种酸式盐,确定A为碳酸氢铵,
(1)依据判断A为碳酸氢铵,故答案为:碳酸氢铵;
(2)物质B是NO,工业用途可以工业制硝酸(或制氮肥,制氨水等),故答案为:工业制硝酸(或制氮肥,制氨水等);
(3)工业上制取气体B(NH3)是用氢气和氮气高温高压催化剂条件下合成氨,反应的化学方程式为:N2+3H2催化剂.高温高压2NH3,故答案为:N2+3H2催化剂.高温高压2NH3;
(4)E(NO)一氧化氮易和空气中的氧气反应,难溶于水,可以用排水法收集,F(NO2)和水反应,比空气重,可以用向上排空气法收集,故答案为:排水法 向上排空气法.
本题解析:
本题难度:一般
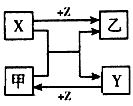
4、推断题 (8分)B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体。
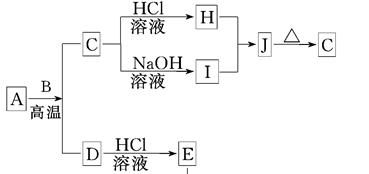
(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是________________________.
(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:____________________________;
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式:?。
(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1。则反应物中A、D、HCl的物质的量之比为____。
参考答案:(8分)(1)先生成白色沉淀,迅速变为灰绿色,最终变为红褐色.(2分)
(2) Fe2O3+2Al Al2O3+2Fe?(2分)
Al2O3+2Fe?(2分)
Fe3+ + 3AlO2- + 6H2O ="=" 3Al(OH)3↓+ Fe(OH)3↓?(2分)
(3)1:2:8?(2分)
本题解析:A是一种红棕色金属氧化物,则A是氧化铁。电解熔融态的C得到B单质,而J是一种难溶于水的白色固体,这说明C是氧化铝,B是金属铝,H是氯化铝,I是偏铝酸钠,二者反应生成氢氧化铝,即J是氢氧化铝。A和B的反应是铝热反应,则D是铁,E是氯化亚铁。
点评:该题是高考中的常见题型,试题综合性强,难度较大,对学生的综合素质提出了更高的要求。该题学生需要明确化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:困难
5、填空题 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
(1)若A、B、D的焰色反应均为黄色,且E为一种酸性的温室气体.
①写出A溶液→B溶液的离子方程式______.
②下面关于化合物A、B、D的说法正确的是______.
A.等物质的量的D与A均匀混合加热最后可得纯净物
B.用稀盐酸和澄清石灰水及相应的仪器即可检验D溶液中是否含B
C.用A溶液即可鉴别CuSO4、FeCl2、Fe2(SO4)3、Al(NO3)3、KAlO2溶液
D.往28.6g?B?10H2O晶体中缓慢加入10ml?1mo1?L-1H2SO4可得22.4L气体E
(2)若A为一种金属的盐酸盐RCl3,R与盐酸或氢氧化钠溶液反应均产生氢气.
①写出R与氢氧化钠溶液恰好反应得到的溶液中离子浓度的大小顺序______.
②写出A溶液与D溶液反应的离子方程式______.
(3)若A与D相遇会产生白烟,则①实验室制取A的化学方程式为______.②B中的化学键类型为______.③检验A的方法及结论为______.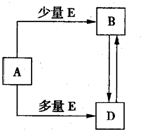
参考答案:(1)若A、B、D的焰色反应均为黄色,应含有Na元素,E为一种酸性的温室气体,应为CO2,则A为NaOH,B为Na2CO3,D为NaHCO3,则
①A溶液→B溶液的离子方程式为2OH-+CO2═CO32-+H2O,故答案为:2OH-+CO2═CO32-+H2O;
②A.等物质的量的NaOH和NaHCO3发生NaOH+NaHCO3=Na2CO3+H2O,混合加热可得Na2CO3,故A正确;
B.Na2CO3和NaHCO3都与盐酸反应生成CO2,不能用盐酸检验,故B错误;
C.所含阳离子不同,分别加入NaOH,产生蓝色沉淀、生成白色沉淀迅速变为灰绿色,会后变成红褐色、红褐色沉淀、先生成白色沉淀,后溶解等不同现象,可鉴别,故C正确;
D.往28.6g?Na2CO3?10H2O晶体中缓慢加入10ml1mo1?L-1H2SO4,n(Na2CO3?10H2O)=0.1mol,n(H2SO4)=0.01mol,生成NaHCO3,没有气体放出,故D错误.
故答案为:AC;
(2)若A为一种金属的盐酸盐RCl3,R与盐酸或氢氧化钠溶液反应均产生氢气,则R为Al,E为NaOH,A为来源:91 考试网AlCl3,B为Al(OH)3,D为NaAlO2,
①Al与氢氧化钠溶液恰好反应得到NaAlO2,为强碱弱酸盐,水解呈碱性,溶液存在c(Na+)>c(AlO2-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(AlO2-)>c(OH-)>c(H+);?
②AlCl3溶液与NaAlO2溶液发生互促水解反应生成Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O═4Al(OH)3↓;
(3)若A与D相遇会产生白烟,应生成NH4Cl,A为NH3,E为Cl2,B为NH4Cl,D为HCl,则
①实验室制取NH3的化学方程式为2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;
②B为NH4Cl,含有离子键和极性键(或共价键),故答案为:离子键和极性键(或共价键);
③NH3为碱性气体,可用湿润的红色石蕊试纸检验,试纸变蓝色,
故答案为:用湿润的红色石蕊试纸,若变蓝则证明为氨气.
本题解析:
本题难度:一般