1、推断题 A、B、C,D、E、F六种强电解质在水中电离出的离子如下表所示,用洁净的铂丝分别蘸取B、D、F三种溶液在无色火焰上灼烧,火焰均呈黄色。
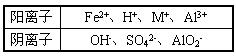
另有甲、乙、丙三种固体,分别是铝粉,铁粉和Al(OH)3固体中的一种,它们与A、B、C、D、E、F在常温下有如下转化关系:①固体乙+B溶液→F溶液+氢气 ②固体甲+C溶液→E溶液+氢气 ③过量C溶液+F溶液→D溶液+A溶液+水 请回答下列问题:
(1)M+的结构示意图为_______________________。
(2)写出下列物质的化学式:甲________________,B________________。
(3)写出反应③的离子方程式:_________________________________。
(4)常温下,A、B、C、D、E、F六种物质中,能促进水的电离且其水溶液pH<7的是____________(填化学式)。
(5)相同质量的A分别与题中涉及的某些物质反应均生成丙,其中生成丙的质量最大的反应的化学方程式为________________________________________。
参考答案:
(1)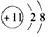
(2)Al;NaOH
(3)4H++AlO2-=Al3++2H2O
(4)Al2(SO4)3·FeSO4
(5)Al2(SO4)3+6NaAlO2+12H2O=8Al(OH)3↓+3Na2SO4
本题解析:
本题难度:一般
2、简答题 某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验?④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失.
请回答下列问题:
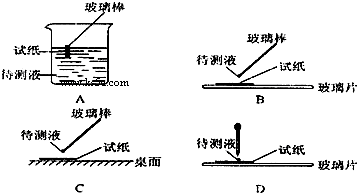
(1)在实验?①中,下图所示的操作中正确的是______(填代号).
(2)根据上述实验判断原溶液中肯定存在的离子是______,肯定不存在的离子是______.
(3)写出与②③两个实验有关的离子方程式:
②______
③______.
参考答案:(1)用试纸检验溶液的酸碱性时,应用玻璃棒蘸取少量溶液滴在放在玻璃片的试纸上检验,故答案为:B;
(2)①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-,溶液无色,则不存在Fe3+;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-,;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子,;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验?④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡,
故答案为:Al3+、NO3-、SO42-;Fe3+、Ba2+、HCO3-;
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
③根据Al(OH)3不溶于弱碱,则在含Al3+溶液中加入氨水只生成Al(OH)3,反应的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+.
本题解析:
本题难度:一般
3、填空题 (14分)下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和 C呈气态,且B是导致酸雨的大气污染物,W是淡黄色固体。
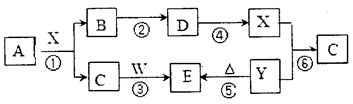
据此回答下列问题:
(1)物质W中所含有的化学键类型为_________,其阴、阳离子个数比为_________。
(2)物质C的结构式为____________。
(3)上图反应中不属于氧化还原反应的有______________(填写序号)。
(4)写出A和X反应的化学方程式_____________;若生成的B在标准状况下的体积为? 22.4L,则反应中转移电子数目为_____________。
(5)请写出C和W反应的化学方程式:_______________。
(6)请写出X和Y反应的离子方程式:_________________。
参考答案:(1)离子键和共价键(1分)? 1︰2?(1分)
(2)? O=C=O?(2分)
(3)④⑤⑥(2分)
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分);? 1.204×1024(2分)
CO2↑+2SO2↑+2H2O(2分);? 1.204×1024(2分)
(5)2Na2O2+2CO2=2Na2CO3+O2(2分)
(6)H++HCO3-=CO2↑+H2O(2分)
本题解析:B是导致酸雨的大气污染物,W是淡黄色固体,所以B是二氧化硫,W是过氧化钠。C呈气态,且与过氧化钠反应,因此C是二氧化碳,E是碳酸钠。Y分解生成碳酸钠,所以Y是碳酸氢钠。X与碳酸氢钠反应生成二氧化碳,所以X是酸,因此是硫酸,则D是三氧化硫,溶于水即得到硫酸。在加热时碳和浓硫酸反应就生成二氧化碳和二氧化硫。
本题难度:一般
4、简答题 已知:A为单质,常温下C、D为气态.F是三大强酸之一,X为常见金属.图中部分反应物和生成物略去.
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体,则
①写出C的化学式:______.
②D→E为工业生产F的重要反应之一,写出此反应的化学方程式______;写出气体D使溴水褪色生成F的离子方程式______.
(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,E为红棕色气体,则
①写出A的电子式:______,C分子的空间构型为______.
②若X为铝热反应的引燃剂,写出由A生成B的化学方程式:______.
③写出D与氧气、水反应生成F的总化学方程式:______.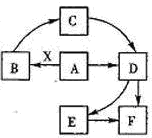
参考答案:A为单质,常温下C、D为气态.F是三大强酸之一为盐酸、硫酸、硝酸,X为常见金属,
(1)若A为固体,B是黑色固体,C是臭鸡蛋气味的气体判断C为H2S;A为S,B为FeS;D为SO2,E为SO3;F为H2SO4;B为FeS;
①C的化学式为H2S,故答案为:H2S;
②D→E为工业生产F的重要反应之一,是二氧化硫催化氧化为三氧化硫的反应,此反应的化学方程式为:2SO2+O2催化剂.△2SO3;气体D是二氧化硫使溴水褪色生成F的离子方程式为:
SO2+Br2+2H2O=SO42-+4H++2Br-,故答案为:2SO2+O2催化剂.△2SO3;SO2+Br2+2H2O=SO42-+4H++2Br-;
(2)若A为气体,C可以使湿润的红色石蕊试纸变蓝,判断C为NH3,E为红棕色气体结合反应生成酸判断为NO2;D为NO;A为N2;B为;F为HNO3;
①A为N2,它的电子式为:
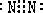
C是NH3,分子结构为三角锥形,故答案为:
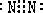
;三角锥形;
②X为铝热反应的引燃剂判断为镁,由A生成B的化学方程式为:3Mg+N2?点燃?.?Mg3N2,故答案为:3Mg+N2?点燃?.?Mg3N2;
③D为NO与氧气、水反应生成F为HNO3的总化学方程式为:4NO+3O2+2H2O=4HNO3,故答案为:4NO+3O2+2H2O=4HNO3.
本题解析:
本题难度:一般
5、简答题 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
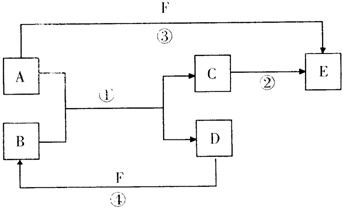
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、D、F所含元素的原子序数之和为28,则F所含元素在周期表中的位置是______;反应①的化学方程式是:______.
(2)若A是生产和生活中使用最多的金属单质,D、F是气态单质,反应①、反应②都在水溶液中进行,则反应②的离子方程式是:______;实验室D在F中安全的进行反应时,④的现象是______.
(3)若B、C、F都是气态单质,且B有毒,③和④两个反应中都有水生成,反应②、③、④都需要一定条件才能发生,A、D相遇有白烟生成,则C的电子式是______;反应③的化学方程式是______.
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都会生成有颜色的气体,B的结构式是______;反应③的化学方程式是______.
参考答案:(1)短周期元素同主族元素之间的置换反应有多种,如Na→H2,O2→S,C→Si等,若A、D、F都是非金属单质,且A、D所含元素同主族,A、D、F所含元素的原子序数之和为28,则A为C,D为Si,F为O2,O位于周期表第二周期第ⅥA族,反应①为SiO2+2C?△?.? Si+2CO↑,
故答案为:第二周期第ⅥA族;SiO2+2C?△?.? Si+2CO↑;
(2)若A是生产和生活中使用最多的金属单质,应为Fe,D、F是气态单质,应分别为H2、Cl2,C生成E的反应为2Fe2++Cl2=2Fe3++2Cl-,D在F中安全的进行反应时,有苍白色火焰,由于HCl易溶于水,在空气中形成白雾,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;安静的燃烧,苍白色火焰,并有白雾;
(3)若B、C、F都是气态单质,且B有毒,则B为Cl2,为Cl2和NH3的反应,生成N2和HCl,N2的电子式为
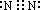
,NH3和氧气反应生成NO和水,为工业制硝酸的反应,化学方程式为
4NH3+5O2 ?催化剂?.△4NO+6H2O,
故答案为:
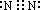
;4NH3+5O2 ?催化剂?.△4NO+6H2O;
(4)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,则A为Mg,D为C,为MgO和C的反应,CO2的结构式为O=C=O,
方程式为Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O,
故答案为:O=C=O;Mg+4HNO3(浓)=Mg(NO3)2+2NO2↑+2H2O.
本题解析:
本题难度:一般