1、填空题 (7分)下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
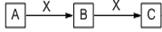
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为?
(2)若A为有臭鸡蛋气味的气体,C为H2SO3的酸酐,则B为:?,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为?
参考答案:(1)2NO+O2= 2NO2(2分)
(2)S(或硫)(2分)? 0.5<a<1.5 (3分)
本题解析:略
本题难度:一般
2、填空题 ( 8分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
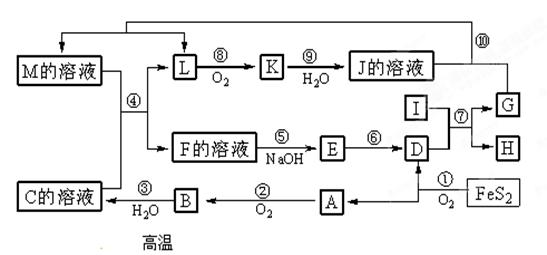 (提示:4FeS2+11O2
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)
请填写下列空白:
⑴ 在周期表中,组成单质G的元素位于第___? _?_周期_________族。
⑵ 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
⑶ 在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
⑷ 反应④的离子方程式是:______________________________________________。
⑸ 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:__________________________________。
参考答案:(1)四(或4);Ⅷ?(2)1:2?(3)③?
(4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O?
(5)Fe2O3+3KNO3+4KOH =2K2FeO4+3KNO2+2H2O
本题解析:由K是一种红棕色气体,可知K是NO2,L是NO。由I是由第三周期元素组成的单质中熔点最高的金属,可知I是Al,又根据4FeS2+11O2 2Fe2O3+8SO2,可推得D是Fe2O3,A,是SO2, B是SO3, C是H2SO3。I和D发生铝热反应生成Fe和Al2O3,由纵观前面的反应,可推得G是Fe,H是Al2O3。则M的溶液为Fe(NO3)3溶液,M和C反应生成NO和Fe2(SO4)3,可得F是Fe2(SO4)3,E是Fe(OH)3。因此(1)题组成单质Fe的元素就位于第四周期Ⅷ族。(2)题反应⑦Fe和Al2O3发生铝热反应,氧化剂Al2O3与还原剂Fe的物质的量之比为1:2。(3)题②是SO2和O2反应生成SO3,是化合反应但同时也是氧化还原反应,③是SO3和水反应生成H2SO3既属于化合反应又属于非氧化还原反应,⑥是分解Fe(OH)3生成Fe2O3属于分解
2Fe2O3+8SO2,可推得D是Fe2O3,A,是SO2, B是SO3, C是H2SO3。I和D发生铝热反应生成Fe和Al2O3,由纵观前面的反应,可推得G是Fe,H是Al2O3。则M的溶液为Fe(NO3)3溶液,M和C反应生成NO和Fe2(SO4)3,可得F是Fe2(SO4)3,E是Fe(OH)3。因此(1)题组成单质Fe的元素就位于第四周期Ⅷ族。(2)题反应⑦Fe和Al2O3发生铝热反应,氧化剂Al2O3与还原剂Fe的物质的量之比为1:2。(3)题②是SO2和O2反应生成SO3,是化合反应但同时也是氧化还原反应,③是SO3和水反应生成H2SO3既属于化合反应又属于非氧化还原反应,⑥是分解Fe(OH)3生成Fe2O3属于分解
⑨是NO2和水的反应中不属于化合反应但属于非氧化还原反应。所以该题的答案是③。(4)题反应④的离子方程式是:3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O。(5)题,由题意得生成物中有K2FeO4,根据氧化还原反应得失电子守恒,可得该化学反应的化学反应方程式是:Fe2O3+3KNO3+4KOH =2K2FeO4+3KNO2+2H2O
点评:本题综合了氮和硫的氧化物和水合物的相关知识,但推断过程不是很复杂,需要学生记住一些常见的化学反应,掌握氧化还原反应方程式的配平和推导。
本题难度:困难
3、填空题 ((2)题每空3分,其余每空2分,共12分)A、B、C、D均为中学化学常见的物质,它们之间的反应关系如下图:

回答下列问题:
(1)若A是可溶性的强碱,B是酸式盐,D不溶于稀硝酸,则B的化学式为________________,有关的离子方程式为___________________________________?。
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①若C为能使澄清石灰水变浑浊的无色无味气体,该反应的离子方程式为
____________________________________________________?。?
②若A是一种淡黄色固体,且A与B以物质的量之比3∶1混合时,推知B的化学式为
_________?_。
(3)若B为Ca(HCO3)2溶液,A与B的溶液反应时只生成气体C、CaCO3和水,则A的化学式为__________________??。
参考答案:((2)题每空3分,其余每空2分,共12分)
(1)NH4HSO4(2分) NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3↑+2H2O+BaSO4↓(3分)
(2)① 3CO32- + 2Al3+ + 6H2O = 3CO2↑+ 2Al(OH)3↓
或 3HCO3-+ Al3+ ="=" 3CO2↑+ Al(OH)3↓ (3分)② Al2(SO4)3(2分);(3)CaC2(2分)
本题解析:(1)D不溶于稀硝酸,则D时硫酸钡或氯化银。A是可溶性的强碱,B是酸式盐,且反应中生成气体,则气体一定氨气,即A是氢氧化钡,B是硫酸氢铵,方程式为NH4+ + H+ + SO42- + Ba2+ + 2OH- = NH3↑+2H2O+BaSO4↓。
(2)D既可溶于盐酸又可溶于NaOH溶液,则D是氢氧化铝。
①C为能使澄清石灰水变浑浊的无色无味气体,则C是CO2,所以方程式为3CO32- + 2Al3+ + 6H2O = 3CO2↑+ 2Al(OH)3↓,或 3HCO3-+ Al3+ ="=" 3CO2↑+ Al(OH)3↓。
②A是一种淡黄色固体,则A是过氧化钠。A与B以物质的量之比3∶1混合,说明B中含有2个铝离子,所以B是硫酸铝。
(3)由于反应中生成碳酸钙沉淀,所以产生的气体应该是A和水反应生成的,所以根据原子守恒可知,A是CaC2。CaC2溶于水生成乙炔和氢氧化钙,氢氧化钙和碳酸氢钙反应生成碳酸钙和水。
本题难度:一般
4、填空题 (12分)A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。已知:(Ⅰ)A为金属单质; B为红褐色固体;E为密度最小的气体;G为浅绿色溶液。
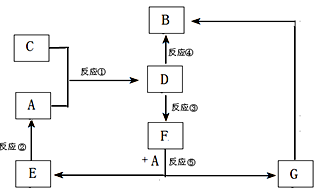
(Ⅱ)D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
(Ⅲ)D能将某种氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)上述反应中属于置换反应的是?(填序号)。
(2)G生成B有多种途径。若在G的溶液中加入与G等物质的量的Na2O2,恰好使G转化为F,写出该反应的离子方程式:
反应③(即D将某种氧化物氧化为F)的离子方程式
(3)实验室制取C的化学方程式为
对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023 个。请按照要求填空:
实验步骤
| 实验现象
| 用化学用语解释
|
将少量气体通入淀粉KI溶液
| 溶液最初变成?色
| (用离子方程式表示)
|
继续通入气体
| 溶液逐渐变成无色
| (用化学方程式表示)
参考答案:(本题12分)
(1)②⑤(2分)?
(2)? 4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+(2分)
2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+ ?(2分)
(3)MnO2 + 4 HCl(浓) Mn Cl2+Cl2↑+2 H2O(2分) Mn Cl2+Cl2↑+2 H2O(2分)
实验步骤
实验现象
用化学用语解释
?
蓝(1分)
Cl2+ 2I-= I2+2Cl-(1分)
?
?
5Cl2+ I2+6H2O= 2HIO3+10 HCl(2分)
本题解析:(1)本题是无机框图题,关键是找准突破点。B为红褐色固体,所以B是氢氧化铁;E为密度最小的气体,则E是氢气;G为浅绿色溶液,因此G中含有亚铁离子。又因为A是金属单质,且A、B、D、G含有同种元素,所以A是铁。D为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,所以D是氯化铁,则C是氯气。D能将某种氧化物氧化为F,F是含有三种元素的化合物,所以根据反应⑤可知,F应该是硫酸,因此G是硫酸亚铁。根据转化可知,反应是化合反应,②⑤是置换反应,③是氧化还原反应,④是复分解反应。
(2)过氧化钠溶于水生成氢氧化钠,同时过氧化钠还具有强氧化性,能把亚铁离子氧化生成铁离子,因此该反应的方程式是4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+;铁离子能把SO2氧化生成硫酸,反应的离子方程式是2Fe3++SO2+2 H2O =2Fe2++SO42-+4 H+。
(3)实验室制取氯气的化学方程式是MnO2 + 4 HCl(浓) Mn Cl2+Cl2↑+2 H2O。氯气具有强氧化性,能把碘离子氧化生成单质碘,碘遇淀粉显蓝色,因此反应的方程式是Cl2+ 2I-= I2+2Cl-;当氯气过量时,可以继续氧化单质碘。每消耗0.1mol KI,反应中转移的电子数约为3.612×1023 个,则碘离子失去电子的个数是10×3.612×1023÷6.02×1023 =6,因此碘的化合价从-1价升高到+5价,即氧化物是碘酸,所以反应的方程式是5Cl2+ I2+6H2O= 2HIO3+10 HCl。 Mn Cl2+Cl2↑+2 H2O。氯气具有强氧化性,能把碘离子氧化生成单质碘,碘遇淀粉显蓝色,因此反应的方程式是Cl2+ 2I-= I2+2Cl-;当氯气过量时,可以继续氧化单质碘。每消耗0.1mol KI,反应中转移的电子数约为3.612×1023 个,则碘离子失去电子的个数是10×3.612×1023÷6.02×1023 =6,因此碘的化合价从-1价升高到+5价,即氧化物是碘酸,所以反应的方程式是5Cl2+ I2+6H2O= 2HIO3+10 HCl。
本题难度:一般
5、填空题 X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:
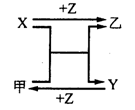
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为?,乙的电子式为?。
(2) 若X基态原子外围电子排布式为3s1,甲是由两种短周期元素的原子构成的AB4型非极性分子,且是常见的有机溶剂,甲的电子式?,乙的化学式为?。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:?,Y原子基态电子排布式为?。
参考答案:(1)Y原子的基态轨道表示式为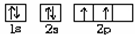 ,乙的电子式为? Mg2+[ ,乙的电子式为? Mg2+[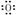 ]2-。 ]2-。
(2)甲的电子式为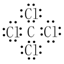 ,乙的化学式为NaCl。 ,乙的化学式为NaCl。
(3)X与甲反应的化学方程式为: 8Al? +? 3Fe3O4?="=" 9Fe + 4Al2O3?
Y原子基态电子排布式为 [Ar]3d64s2?。? (每空2分)
本题解析:(1)X为Mg;甲为CO2,乙为MgO;Y为C,Z为O2;
(2)X为Na;甲为CCl4,乙为NaCl,Y为C,Z为Cl2;
(3)X为Al;甲为Fe3O4,乙为Al2O3,Y为Fe,Z为O2;
本题难度:一般
|