1、推断题 某棕黄色气体A由两种短周期元素组成,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强.常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气的主要成分之一。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为________气体单质D对应元素在周期表中的位置为_______?
(2)用化学方程式表示B溶液酸性增强的原因________________
(3)气体A与NH3反应的化学方程式为________,该反应体现气体A具有________性。反应后的溶液中各种离子浓度由大到小的顺序为________________
(4)试写出制取气体A的化学方程式为________________
(5)设计实验探究离子晶体C的成分。
________________________________
2、填空题 X、Y、Z、W是原子序数依次增大的短周期元素,互不同族,其中只有两种为金属元素;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。Y和W的单质都能与NaOH溶液反应。请回答下列问题:
(1)X元素的名称是_________,Y、Z、W的原子半径由小到大的顺序是________(用元素符号表示)。
(2)W元素在周期表中的位置是__________,Y元素的原子结构示意图是___________。
(3)Z和W在一定条件下能形成化合物ZW2,分子中各原子均达到了8电子稳定结构,则ZW2的电子式是_______;它在常温下呈液态,形成晶体时,属于________晶体。
(4)X的单质与Y的单质化学性质相似,则X的单质与NaOH溶液反应的离子方程式是_______________(注:生成物中,含有X元素的化合物的化学式中含有2个氧原子)
(5)0.1mol W的单质与50 mL 1.5 mol·L-1的FeBr2溶液反应,被氧化的Fe2+和Br-的物质的量之比是____________。
3、填空题 (10分)下已知A~K均为中学化学中的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。

请回答以下问题:
(1)E中阳离子的结构示意图为?。
(2)CO2的电子式为?。
(3)向F中通入足量CO2生成K的离子方程式?。
(4)写出H在空气中生成I的化学方程式?。
( 5 )写出E到F的离子方程式??。
4、选择题 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是(? )
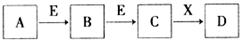
A.若D是一种强碱,则A、B、C均可与X反应生成D
B.若D为NaCl,且A可与C反应生成B,则E可能是CO2
C.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
5、推断题 现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)根据上述转化关系图回答
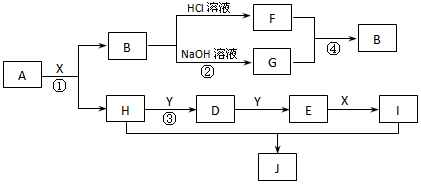
(1)写出下列物质的化学式X_________、G_________;
(2)物质H的电子式:___________;物质J属于哪种晶体类型:___________。
(3)写出反应①的化学方程式_________________;写出反应④的离子方程式___________________。