1、简答题 物质A~I以及X有如下转化关系.已知:只有A、B、D为单质,有些反应的条件和部分产物省略未写.

(1)写出下列物质的化学式:A______D______.
(2)写出框图中对应化学方程式:
③______;
④______.
(3)书写图中反应②的离子方程式:______.
(4)在I溶液中加入足量固体______(填物质的化学式)可转化得到C溶液,且溶液中不含其它杂质.
参考答案:由F→G的颜色变化可知F为Fe(OH)2,G为Fe(OH)3,则H为Fe2O3,I为Fe2(SO4)3,C为FeSO4,E为NH3,则A应为Fe,B为H2,D为N2,X为还原性气体,应为CO,(1)由以上分析可知A为Fe,D为N2,
故答案为:Fe;N2;
(2)③为Fe(OH)2被氧化生成Fe(OH)3的反应,反应的方程式为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
④为Fe2O3被还原生成Fe的反应,反应的方程式为Fe2O3+3CO高温.Fe+3CO2,
故答案为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;Fe2O3+3CO高温.Fe+3CO2;
(3)②为FeSO4和氨水的反应,反应的离子方程式为Fe2++2NH3?H2O═Fe(OH)2↓+2NH4+,
故答案为:Fe2++2NH3?H2O═Fe(OH)2↓+2NH4+;
(4)I为Fe2(SO4)3,具有氧化性,可与Fe反应生成FeSO4,
故答案为:Fe.
本题解析:
本题难度:一般
2、填空题 (10分)有下图所示的反应关系,A是中学常见的无机物,A、B、C中含有同一种元素R,不含R的元素已经略去。
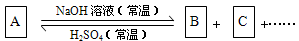
(1)若A与NaOH按不同物质的量比反应,既可只生成B,又可只生成C,还可生成B+C。
①写出符合上述反应关系的A的化学式?。
②写出上述有关反应的离子方程式:
生成B的离子方程式为?。
生成C的离子方程式为?。
(2)若A与NaOH无论以何种物质的量比反应,其产物必为B+C,则A的分子式可能是
?(只写一种),该反应的离子方程式为?。
R在A、B、C中的化合价必须满足的条件是?。
参考答案:(10分)
CO2(或AlCl3);? CO2+2OH-=CO32-+H2O;? CO2+OH-=HCO3-;
Cl2+2OH-=Cl-+ClO-+H2O;? R在A中的化合价处于B、C中化合价之间;
本题解析:略
本题难度:简单
3、填空题 A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品).
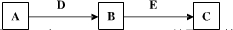
(1)若A为Na,B为NaOH,C为Na2CO3,请写出A转化为B的离子方程式______.
(2)若B为Al2O3,C为钠盐,试写出B转化为C的化学方程式______.
(3)若A为气态单质,B为漂白粉的主要成份之一,C具有漂白性.试写A转化为B的化学方程式______.画出组成单质A的元素原子结构示意图______.
(4)若A、B、C均为钠盐的水溶液,B转化为C是海水中提取溴的原理,请写出B转化为C的离子方程式______.
(5)若B、D为质子数小于18的元素原子形成的单质,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,D为金属,B和C为非金属,请写出A转化为B的化学方程式______.
参考答案:(1)若A为Na,B为NaOH,C为Na2CO3,为NaH2O
本题解析:
本题难度:一般
4、简答题 甲、乙、丙是中学中常见的单质,X、Y、Z是常见的化合物.在常温常压下,甲是具有氧化性的黄绿色气体,丙是棕红色的液体,Y与Z含有相同的阳离子,X与Z含有相同的阴离子;它们之间有以下转化关系:丙+乙→Z;X+丙→Z;X+甲→Y+丙.请回答下列问题:
(1)写出甲、乙、丙三种物质的化学式______、______、______;
(2)写出X与足量的甲在溶液中完全反应时的离子方程式______
(3)欲在实验室中制取并收集纯净、干燥的气体甲,然后完成上述反应“X+甲→Y+丙”,某同学设计了如下图所示的装置.
①装置A中发生反应的化学方程式为______;
②装置B的作用是______;
③装置C中的试剂为______;
④装置D中收集气体甲的方法名称是______;
⑤装置F的主要作用是______,反应原理的离子方程式为______.

参考答案:甲、乙、丙是中学中常见的单质,X、Y、Z是常见的化合物.在常温常压下,甲是具有氧化性的黄绿色气体,则甲为Cl2,丙是棕红色的液体,则丙为Br2,它们之间有以下转化关系:丙+乙→Z;X+丙→Z;X+甲→Y+丙,X与Z含有相同的阴离子,则阴离子为Br-,结合转化关系可知,X、Z含有相同的元素,Y与Z含有相同的阳离子,阳离子中元素为变价元素,可推知乙为Fe,故Z为FeBr3、X为FeBr2、Y为FeCl3,
(1)由上述分析可知,甲为Cl2,乙为Fe,丙为Br2,故答案为:Cl2;Fe;Br2;
(2)FeBr2与足量的氯气在溶液中完全反应时的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,
故答案为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
(3)①装置A制备氯气,实验室利用二氧化锰与浓盐酸在加热条件下制备,反应方程式为:MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)△.MnCl2+Cl2↑+2H2O;
②盐酸易挥发,制备的氯气中含有HCl,用饱和食盐水吸收挥发出来的HCl气体,
故答案为:吸收挥发出来的HCl气体;
③C装置应用干燥氯气,应盛放浓硫酸,
故答案为:浓硫酸;
④氯气的密度比空气大,用向上排空气法收集,
故答案为:向上排空气法;
⑤尾气中有未反应的氯气,直接排放,会污染空气,用氢氧化钠溶液吸收,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:吸收多余的氯气,防止污染环境;Cl2+2OH-=Cl-+ClO-+H2O.
本题解析:
本题难度:简单
5、填空题 A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。

(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式_____________________________________________________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式
_____________________________________________________________________________________。
参考答案:(1)2H2S+SO2=3S+2H2O(2分)
(2)4NH3+5O2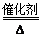 4NO+6H2O(2分) 湿润的红色石蕊试纸(2分)
4NO+6H2O(2分) 湿润的红色石蕊试纸(2分)
(3)第三周期第ⅢA族(2分)2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑
(4)2Na2O2+2H2O=4Na++4OH-+O2↑(2分)
本题解析:(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质,则符合条件的应该是A是S,B是H2S,C是SO2,D是SO3。H2S具有还原性,SO2具有氧化性,二者可以发生氧化还原反应生成单质硫和水,反应的化学方程式为2H2S+SO2=3S+2H2O。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因,这说明是氮元素及其化合物的转化,因此A是氮气,B是氨气,C是NO,D是NO2。氨气发生催化氧化生成NO和水,所以反应③的化学方程式为4NH3+5O2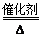 4NO+6H2O。氨气是碱性气体能使湿润的红色石蕊试纸变蓝色,所以可以用湿润的红色石蕊试纸检验氨气。
4NO+6H2O。氨气是碱性气体能使湿润的红色石蕊试纸变蓝色,所以可以用湿润的红色石蕊试纸检验氨气。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,这说明该转化是铝及其化合物的转化,因此符合条件的是A是Al,B是氧化铝,C是偏铝酸钠,D是氢氧化铝。Al元素在周期表中的位置是第三周期第ⅢA族。金属铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,因此②的离子方程式为2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,因此C是过氧化钠,D是氢氧化钠。过氧化钠溶于水即生成氢氧化钠和氧气,所以反应④的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
本题难度:一般