1、简答题 已知A、B、C、D均为气体,E、F均为常温下呈固体的离子化合物,G为氯化钙,A在B中燃烧的火焰呈苍白色,反应②中两气体相遇有大量白烟,它们之间的转化关系如图所示:
(1)写出A、C的化学式:A:______,C:______.
(2)D的电子式为______,D分子的结构呈______形.
(3)在反应①~③中,属于氧化还原反应的是______.
(4)反应②的化学方程式为:______;反应③的化学方程式为:______.
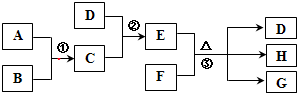
参考答案:A在B中燃烧的火焰呈苍白色,A为H2,B为Cl2,C为HCl,反应②中两气体相遇有大量白烟,则D为NH3,所以E为NH4Cl,E、F均为常温下呈固体的离子化合物,则F为Ca(OH)2,G为氯化钙,则H为水,
(1)由上述分析可知,A为H2,C为HCl,故答案为:H2;HCl;
(2)D为NH3,其电子式为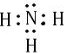 ,空间构型为三角锥,故答案为:
,空间构型为三角锥,故答案为: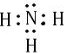 ;三角锥;
;三角锥;
(3)反应①为Cl2+H2点燃.2HCl,反应②为HCl+NH3═NH4Cl,反应③为Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O,只有反应①中有元素化合价变化,属于氧化还原反应,
故答案为:①;
(4)反应②为HCl+NH3═NH4Cl,反应③为Ca(OH)2+2NH4Cl△.CaCl2+2NH3↑+2H2O,
故答案为:NH3+HCl=NH4Cl;2NH4Cl+Ca(OH)2CaCl2+2H2O+2NH3↑.
本题解析:
本题难度:一般
2、填空题 单质A与粉末化合物B组成的混合物相互转化关系如下图所示:
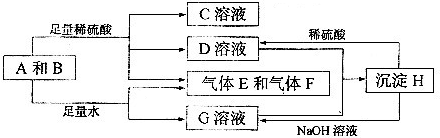
请回答下列问题:
(1)A单质的元素在周期表中处于______.
(2)D与G两溶液混合后发生反应的离子方程式为______.
(3)常温下,D溶液的pH______7(填“>”或“<”或”=”),其原因是______(用离子方程式表示).
(4)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______.
参考答案:单质A与粉末化合物B组成的混合物与酸反应生成CD溶液和气体EF,单质A与粉末化合物B组成的混合物与足量水反应生成气体EF和G溶液;说明单质A和酸碱反应生成气体,判断A为Al;B为能与水反应生成生成碱和气体的物质,推断为Na2O2,转化关系中H可以和酸硫酸反应和碱氢氧化钠反应,说明H为两性物质判断为Al(OH)3;G为NaAlO2,D为Al2(SO4)3;C为Na2SO4,综合推断可知EF为氧气和氢气;
(1)A为铝周期表中在第三周期?IIIA族,故答案为:第三周期 IIIA族;?
(2)D与G两溶液混合后发生反应是偏铝酸钠和硫酸铝混合发生双水解生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)常温下,D溶液是硫酸铝溶液,铝离子水解显酸性,溶液的pH<7,原因是Al3++3H2O?

?Al(OH)3+3H+,
故答案为:<;Al3++3H2O

Al(OH)3+3H+;
(4)用碳棒、稀硫酸、气体E和气体F组成燃料电池是氢氧燃料电池,电解质是酸,原电池中 负极失电子发生氧化反应,正极上得到电子发生还原反应,所以该电池的正极是氧气得到电子发生还原反应,由于是酸性电池,所以电极反应式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
本题解析:
本题难度:一般
3、推断题 各物质之间的转换关系如下图,部分生成物省略。 ? 相关信息如下 i.X为红褐色沉淀;?ii.A为单质,B为溶液,D和F为气体; iii.反应②为某化工生产中的尾气处理方式,产物只有Y和H2O。
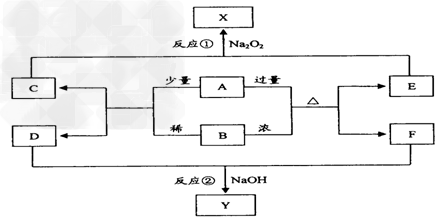
根据以上信息回答下列问题:
(1)组成A的元素在周期表中属于:___________(选填序号);
(A)主族元素?(B)副族元素?(C)过渡元素?(D)短周期元素
(2)写出B物质的化学式:_______________?;
(3)写出反应②的化学反应方程式:____________?;
(4)以石墨为两极材料,电解C的水溶液,写出电解初期阴极的电极反应式:_____________;
(5)28g单质A与一定浓度的B溶液反应,当生成n(C):n(E):2:3时发生转移__________mol电子;
(6)在仅含E的溶液中加入Na2O2生成X时,写出当n(E):n(Na2O2)=1:1时反应的离子方程式:________________。
参考答案:(1)C?
(2)HNO3?
(3)NO+NO2+2NaOH=2NaNO2+H2O?
(4)Fe3+ +e-=Fe2+?
(5)1.2?
(6)4Fe2+ +4Na2O2+6H2O==4Fe(OH)3 +8Na++O2↑
+8Na++O2↑
本题解析:
本题难度:一般
4、填空题 现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出).
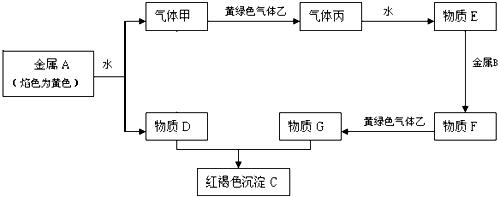
①
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙______?丙______?F______;
(2)写出下列反应的化学方程式或离子方程式:
①金属A和水反应的离子方程式______;
②物质E和金属B反应的离子方程式______;
③物质D和G反应的化学方程式______.
参考答案:黄绿色气体为Cl2,则与Cl2反应的气体甲为H2,丙为HCl,物质E为盐酸,金属A与水反应生成的为碱为NaOH,D为NaOH,盐酸与金属B反应,生成的产物F还能继续与氯气反应,则金属B为变价金属,应为Fe,所以F为FeCl2,G为FeCl3,C为Fe(OH)3;
(1)由以上分析可知,乙为Cl2,丙为 HCl,F为FeCl2;故答案为:Cl2; HCl;FeCl2;
(2)①金属A为钠和水反应的离子方程式:2Na+2H2O=2Na++2OH-+H2↑
②物质E为盐酸,和金属B为Fe反应的离子方程式:Fe+2H+=Fe2++H2↑
③物质DNaOH和GeCl3反应的化学方程式:3NaOH+FeCl3=Fe(OH)3↓+3NaCl
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Fe+2H+=Fe2++H2↑;3NaOH+FeCl3=Fe(OH)3↓+3NaCl
本题解析:
本题难度:一般
5、填空题 已知通常状况下甲、乙、丙、丁等为气体单质,A、B、C、D、E、F、G、H等为化合物,其中A、B、E、G均为气体,C为常见液体。反应①、②、③都是重要的化工反应,反应④是重要的实验室制取气体的反应。有关的转化关系如下图所示(反应条件均已略去)。

请回答下列问题:
(1)反应④的化学方程式为: ________________________。
(2)B和E在一定条件下可发生反应,这是一个具有实际意义的反应,可消除E对环境的污染,该反应氧化产物与还原产物的物质的量之比为________。
(3)0.1mol lL-1A溶液和0.1mol ?L-1B溶液等体积混合,溶液呈________性,原因是(用离子方程式说明) ________________。
(4)请设计实验检验D晶体中的阳离子(简述实验操作、现象和结论):________________。
(5)pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是(用A、D、H表示) : ____________。
(6)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol? L-1 A的溶液100 mL,恰好使混合物全部溶解,且放出336mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取同质量的Fe、FeO、Fe3O4混合物,加入1 mol ? L-1 H的溶液,也恰好使混合物全部溶解,且向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的H溶液的体积是________。
参考答案:(每空2分,最后一空每空3分,共计15分)
(1)2NH4Cl+Ca(OH)2 ?CaCl2+2H2O+2NH3↑?(2)2:3
?CaCl2+2H2O+2NH3↑?(2)2:3
(3)酸性;NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(4)取一支试管加入适量的D晶体,然后加入适量的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明D晶体中含有NH4+
(5)D>A=H?(6)110ml
本题解析:C为常见液体,则C可能是水。通常状况下甲、乙、丙、丁等为气体单质,则丙和丁应该是氢气和氧气。A和B都是化合物,且都是气体。又因为A和B可以反应生成D,D和F反应生成B、C、I,且该反应是重要的实验室制取气体的反应,由此可以推测,该反应是实验室制取氨气的反应,所以丁是氢气,丙是氧气,B能和氧气反应生成水和E,所以B是氨气,则乙是氮气,A是氯化氢,甲是氯气,D是氯化铵,F是氢氧化钙,I是氯化钙。E是NO,G是NO2,NO2溶于水生成硝酸和NO,则H是硝酸。
(1)反应④的化学方程式为2NH4Cl+Ca(OH)2 ?CaCl2+2H2O+2NH3↑。
?CaCl2+2H2O+2NH3↑。
(2)氨气与NO反应生成氨气和水,反应的化学方程式为4NH3+6NO=5N2+6H2O,其中还原剂是氨气,氧化剂是NO,氮气既是氧化产物,也是还原产物。由于还原剂与氧化剂的物质的量之比是2:3,所以该反应氧化产物与还原产物的物质的量之比也为2:3。
(3)0.1mol lL-1A溶液和0.1mol ?L-1B溶液等体积混合恰好反应生成氯化铵,溶液中NH4+水解,所以溶液显酸性,反应的离子方程式为NH4++H2O NH3·H2O+H+。
NH3·H2O+H+。
(4)D是氯化铵,阳离子是NH4+,NH4+能和碱反应生成氨气,因此可以通过检验氨气来证明晶体中含有NH4+,所以正确的操作是取一支试管加入适量的D晶体,然后加入适量的NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明D晶体中含有NH4+。
(5)盐酸和硝酸都是酸抑制水的电离,在二者浓度相同的条件下对水的抑制程度相同。氯化铵是强酸弱碱盐,溶于水NH4+水解,促进水的电离,所以pH相同的A、D、H三种溶液,由水电离出的c(OH-)的大小关系是D>A=H。
(6)溶液中均没有出现红色,则溶液中的溶质分别是氯化亚铁和硝酸亚铁,且二者的物质的量均是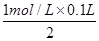 =0.05mol。336ml气体是氢气,其物质的量是0.336L÷22.4L/mol=0.015mol,则根据电子转移相等可知,被还原的硝酸的物质的量是
=0.05mol。336ml气体是氢气,其物质的量是0.336L÷22.4L/mol=0.015mol,则根据电子转移相等可知,被还原的硝酸的物质的量是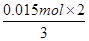 =0.01mol,所以根据氮原子守恒可知,硝酸的物质的量是0.05mol×2+0.01mol=0.11mol,因此硝酸的体积是0.11mol÷1mol/L=0.11L=110ml。4+检验、盐类水解、外界条件对水电离平衡的影响以及氧化还原反应的有关计算等
=0.01mol,所以根据氮原子守恒可知,硝酸的物质的量是0.05mol×2+0.01mol=0.11mol,因此硝酸的体积是0.11mol÷1mol/L=0.11L=110ml。4+检验、盐类水解、外界条件对水电离平衡的影响以及氧化还原反应的有关计算等
本题难度:一般