|
高考化学知识点总结《离子共存》在线测试(2017年最新版)(十)
2018-03-17 06:45:57
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列各组离子在酸性溶液中可以大量共存的是
A.Cu2+、K+、SO42-、NO3-
B.NH4+、Ba2+、Cl
|
参考答案:
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是( )
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2] = 1∶1时,HCO3-完全转化为CaCO3
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2] = 1∶1时,能得到澄清溶液
C.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+) = 1∶1时,铝元素以AlO2-形式存在
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3) = 1∶1时,溶液中铁元素只以Fe3+形式存
参考答案:A
本题解析:A项,HCO3-与OH-以1∶1恰好完全反应,离子方程式为:HCO3-+ OH-= CO32-+H2O,题给条件中,OH-过量,HCO3-完全转化为CO32-,A项正确。B项,CO2与澄清石灰水的反应方程式有①少量CO2:CO2+Ca(OH)2=CaCO3↓+H2O ②CO2足量:CO2+Ca(OH)2= Ca(HCO3)2,所以B中将会得到白色沉淀,B不正确。AlCl3溶液与烧碱溶液反应,当NaOH溶液少量时,离子方程式:Al3+ +3OH-=Al(OH)3↓ ;当NaOH溶液过量时,离子方程式为:Al(OH)3+ OH- =AlO2-+2H20,由此判断,当n(OH-)∶n(Al3+) = 1∶1时,只能出现白色沉淀,C不正确。Fe与稀硝酸反应的方程式:①Fe过量时:3Fe + 8H+ + 2NO3- = 3Fe2+ + 2NO↑+ 4H2O ②硝酸过量时:Fe + 4H+ + NO3- = Fe3+ + NO↑+ 2H2O,当n(Fe)∶n(HNO3) = 1∶1时,则Fe过量,所以D不正确。
本题难度:简单
3、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO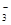 、ClO- 、ClO-
B.0.1 mol·L-1FeCl3溶液:NH 、H+、I-、SCN- 、H+、I-、SCN-
C.0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO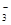 、SO 、SO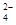
D.使酚酞变红色的溶液:Na+、Ba2+、NO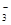 、Cl- 、Cl-
参考答案:D
本题解析:A、酸性溶液,HSO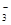 、ClO-均与氢离子结合为弱酸,还有ClO-能把Fe2+、HSO 、ClO-均与氢离子结合为弱酸,还有ClO-能把Fe2+、HSO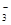 氧化,错误;B、Fe3+与I-发生氧化还原反应,与SCN-形成配合物不能大量共存,错误;C、Ca2+不能大量共存,错误;D、正确。 氧化,错误;B、Fe3+与I-发生氧化还原反应,与SCN-形成配合物不能大量共存,错误;C、Ca2+不能大量共存,错误;D、正确。
本题难度:一般
4、选择题 在pH =1时,可大量共存且形成无色溶液的一组离子或分子是
[? ]
A.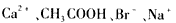
B.
C.
D.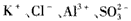
参考答案:A
本题解析:
本题难度:一般
5、选择题 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性稍有变化但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是:
A.NaOH溶液
B.蒸馏水
C.Na2SO3溶液
D.KI溶液
参考答案:C
本题解析:
【错解分析】本题错解之一是由于思维定势,对液体吸收气体容量大简单地理解为溶解度较大。常温下氯气在水中的溶解度为1∶2,属于可溶范围,符合吸收容量大的条件;再考虑氯气溶于水生成盐酸和次氯酸的导电性比蒸馏水大大增强,灵敏度也好。因此,选择了B选项。实际上气体的溶解度表示的是在1L水中溶解的气体体积数,而相同物质的量的气体和液体、固体在体积上相差一千倍左右,如:1mol任何气体在标况下的体积为22.4L;1mol水18mL。若1L溶液中含有1mol溶质,它吸收1mol的气体(22.4L),比溶解的气体多得多,何况溶质的物质的量要大,吸收的容量将更大。
错解之二是知识欠缺,只知道氯气能和NaOH溶液反应,生成氯化钠和次氯酸钠,生成物的种类增多,导电的离子浓度增大。因此,兼顾容量和导电性变化的灵敏度。实际上氯气和氢氧化钠的反应如下:
Cl2+2NaOH==NaCl+NaClO+H2O
2molNaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电的灵敏度不变。
【正解】由于氯气和亚硫酸钠发生如下反应:
Cl2+Na2SO3+H2O==2HCl+Na2SO4
从吸收容量上看:用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电量总量看),符合导电的灵敏度增大,导电性增强。选项C为正确答案。
本题难度:简单
|