1、选择题 以下变化后物质的总能量升高的是
A.钢铁生锈
B.气态SO3变成固态三聚物
C.水电解
D.1,3-环己二烯生成苯
参考答案:C
本题解析:物质的总能量升高说明是吸热反应。 A.钢铁生锈是自发的氧化还原反应,为放热反应,错误;B.气态SO3变成固态三聚物,要发出热量,错误;C.水电解是分解反应,是吸热反应,正确;D.1,3-环己二烯生成苯是加成反应,要放出热量,错误;答案选C。
本题难度:一般
2、选择题 已知:①101 kPa时,C(s)+1/2O2(g)===CO(g) ΔH1=-110.5 kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ/mol?
下列结论正确的是
A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1
B.若碳的燃烧热用ΔH3来表示,则ΔH3>ΔH1
C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
参考答案:A
本题解析:ΔH3是指1mol C完全燃烧生成CO2后所放出的热量,而ΔH1是指C不完全燃烧生成CO所放出的热量,所以ΔH3<ΔH1,所以A正确,B错误;C选项中,是浓硫酸和稀NaOH反应,而浓硫酸稀释会放出大量的热,所以C错误;D选项中,稀醋酸是弱电解质,溶解过程中要吸热,所以和1mol NaOH反应放出的热小于57.3kj,所以D错误。
本题难度:一般
3、选择题 根据相关化学概念和原理,下列判断正确的是?(?)
A.若某反应的生成物总能量低于反应物总能量,则该反应为吸热反应
B.若A2+2D-=2A-+D2,则氧化性:D2>A2
C.若R2-和M+的电子层结构相同,则原子序数:R>M
D.若甲、乙两种有机物具有相同的分子式,不同的结构,则甲和乙一定是同分异构体
参考答案:D
本题解析:略
本题难度:简单
4、选择题 已知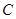 (石墨) =
(石墨) = 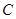 (金刚石),在该反应进程中其能量变化如图所示,有关该反应的描述正确的是(?)
(金刚石),在该反应进程中其能量变化如图所示,有关该反应的描述正确的是(?)

A.该反应为放热反应
B.金刚石比石墨稳定
C.该反应为氧化还原反应
D.石墨比金刚石稳定
参考答案:D
本题解析:根据图像可知石墨的能量低于金刚石的能量,所以该反应是吸热反应。由于能量越低,物质越稳定,所以石墨比金刚石稳定。反应中并没有电子的转移,不属于氧化还原反应。答案选D。
本题难度:一般
5、选择题 对于敞口容器中的反应:Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
A.Zn和H2SO4的总能量大于ZnSO4和H2的总能量
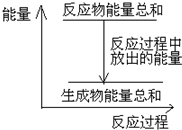
B.反应过程中能量关系可用如图表示
C.若将该反应设计成原电池,则Zn为负极
D.若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体
参考答案:A、Zn和H2SO4的反应是放热反应,所以Zn和H2SO4的总能量大于ZnSO4和H2的总能量,故A正确;
B、因放热反应中反应物的总能量大于生成物的总能量,可用如图表示

,故B正确;
C、因Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)的反应中锌失去电子,化合价升高,作原电池的负极,故C正确;
D、根据总反应:Zn+H2SO4 =ZnSO4 +H2
? 65g?22.4L
? ?65g? ?22.4L
所以65g锌溶解时,正极放出22.4L气体,故D错误;
故选:D.
本题解析:
本题难度:一般