1、填空题 (4分)工业上用赤铁矿生产铁,可以选择的还原剂有C和H2,根据所学的知识判断:
已知:Fe2O3(s)+3/2C(s)=2Fe(s)+3/2CO2(g)? ΔH=+233.8kJ·mol-1? ΔS=279J?K-1?mol-1
Fe2O3(s)+3H2(g)=2Fe(s)+3H2O(g)?ΔH=+98kJ·mol-1?ΔS=144.2J?K-1?mol-1
问:那一种还原剂可使反应自发进行的温度低?(要求计算过程)(保留三位有效数字)
参考答案:用氢气为还原剂,反应自发进行的温度较低
根据ΔH-TΔS=0为平衡状态,ΔH-TΔS<0时为自发过程。计算
用C为还原剂使T1>838K能自发进行
用H2为还原剂时T2>679.6能自发进行
所以,用氢气为还原剂,反应自发进行的温度较低
本题解析:略
本题难度:简单
2、选择题 对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是(? )
A.反应过程中能量关系可用下图表示

B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
参考答案:D
本题解析:D项因为没有指明标准状况,所以错误。
本题难度:一般
3、选择题 已知:(1)H2(g)+1/2O2(g)===H2O(g);?△H1="a" kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g);?△H2="b" kJ·mol-1
(3)H2(g)+1/2O2(g)===H2O(l);?△H3="c" kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l);?△H4="d" kJ·mol-1
下列关系式中正确的是(?)
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:氢气燃烧生成液态水时放出的热量多,所以2c=d<2a=b<0,答案选C。
本题难度:一般
4、填空题 (16分)一种混合动力车,可以分别用电动机、内燃机或者二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车和下坡时内燃机提供推动力,使电动机处于充电状态。目前内燃机以汽油为燃料,电动机一般使用镍氢电池(KOH作电解液)。
试分析回答下列问题:
(1)已知汽车在刹车和下坡时,镍氢电池两电极反应分别为:
甲电极:M+H2O+e-→MH+OH(M为储氢合金,MH为吸附了氢原子的储氢合金)
乙电极:Ni(OH)2+OH--e—→NiOOH+H2O
则在这一过程中甲、乙两电极的名称分别是:甲:?;乙:?。
(2)当汽车上坡或加速时,镍氢电池两电极反应分别为:
甲电极:?;乙电极:?;
电极周围溶液的pH变化是(选填“增大”或“不变”或“减小",下同)甲?;乙?。
(3)内燃机工作时因为部分汽油不完全燃烧会产生污染大气的CO,已知在常温常压下:
C8 H18(1)+25/2 O2(g)=8CO2(g)+9 H2O(g);△H=-5121.9kJ/mol
2CO(g)+O2(g)=2CO2(g);△H=-566.0kJ/mol
H2 O(g)=H2 O(1);△H=-44.0kJ/mol
写出汽油不完全燃烧生成一氧化碳和液态水的热化学方程式:?。
(4)为降低汽车尾气中的一氧化碳的浓度,可采取在汽车的排气管上增加一个补燃器,通过下列反应来实现转化:2 CO(g)+O2(g) 2CO2(g)
2CO2(g)
已知在温度为T的条件下,当补燃器中化学反应速率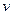 (正)=v(逆)时,各物质浓度存在下列恒定关系:
(正)=v(逆)时,各物质浓度存在下列恒定关系:
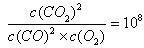
在温度为T的条件下,若某汽车排人补燃器的CO、CO2的浓度分别为1.0×10-5mol·L-1和1.01×10-4mol·L-1,要在该温度下使最终尾气中CO的浓度降为1.0×10-6mol·L-1,则补燃器中应不断补充O2,并使O2浓度保持在?mol·L-1。
参考答案:(16分)

本题解析:略
本题难度:一般
5、计算题 把8.50 g部分已被氧化的锌片放入硫酸铜溶液中,完全反应后取出覆盖有铜的锌片,洗涤干燥后称得质量为8.45 g,求原锌片中有多少克锌片被氧化了。
参考答案:有4.21 g锌片被氧化了
本题解析:很多同学错就错在没有注意审题,要求的是有多少锌被氧化,即原先有多少锌发生了氧化变成了氧化锌。
解:根据化学方程式,设与CuSO4反应的Zn质量为x。
Zn+CuSO4====ZnSO4+Cu?Δm
65? 64? 1
x? 8.50 g-8.45 g="0.05" g
x="3.25" g
m(ZnO)="8.50" g-3.25 g="5.25" g
被氧化的Zn的质量:m(Zn)="5.25" g×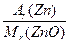 ="5.25" g×
="5.25" g× ="4.21" g
="4.21" g
本题难度:简单